
【题目】书写金属钠和氧的电子排布式___________,________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl (浓)= 2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出电子转移的方向和数目______________________。
(2)该反应中氧化剂与氧化产物物质的量之比是_____________。
(3)由该反应判断,KMnO4的氧化性比Cl2的氧化性(选填“强”或“弱”)_______________。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为___________L。
(5)某同学欲用KMnO4固体配制100mL0.5mol/L的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_________,________。
②下列对容量瓶及其使用方法的描述中正确的是(请填序号)________。
A.容量瓶上标有容积、温度和刻线
B.容量瓶用蒸馏水洗净后,必须50℃烘干
C.配制溶液时,把量好的KMnO4固体小心放入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线
D.使用前要检査容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学们一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀,_____、_____、培养皿。
(2)铁是人类应用最广泛,铁的氧化物有三种,其中Fe3O4是一种具有_____的黑色晶体,俗称磁性氧化铁.Fe2O3的用途________(举一例)。
(3)氢氧化铝其有两性,写出氢氧化铝分别溶于强酸和强碱的离子方程式_____,_______。
(4)在抗震救灾中要用到大量漂白粉和漂白液杀菌消毒,漂白粉的制取过程如下:通过煅烧石灰石得到生石灰,生石灰溶于水得石灰乳,在向石灰乳中通入氯气反应得漂白粉,有关的反应化学方程式为:CaCO3![]() CaO+CO2↑_________、_________。
CaO+CO2↑_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)请你一起参与实验探究并回答下列问题:
Ⅰ.在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①_______________、
②_______________、
③________________。
II.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

⑴各装置连接顺序为_____ →_____ → _____ 。
⑵装置C中装有试剂的名称是_________________。
⑶能证明生成物中有CuCO3的实验现象是________________________。
Ⅲ.若蓝色沉淀中CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其中CuCO3组成:
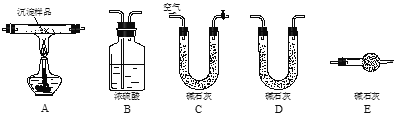
⑴ 实验开始时先要将空气通过碱石灰的目的是____________________;
实验中持续通入过量空气的作用是______________。
⑵若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按构造原理写出第9、17、35号元素原子的电子排布式。它们的核外电子分别有几层?______________最外层电子数分别为多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
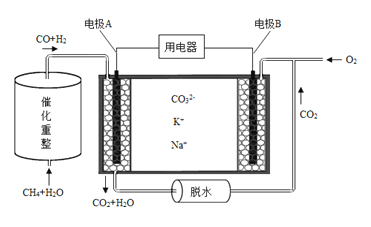
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A. 醋酸溶于水:CH3COOH=CH3COO- + H+
B. NaHCO3溶于水:NaHCO3=Na+ + H+ + CO32﹣
C. NH3通入水中:NH3·H2O ![]() NH4++OH﹣
NH4++OH﹣
D. Na2SO4溶于水中:Na2SO4 ![]() 2Na+ + SO42-
2Na+ + SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com