
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
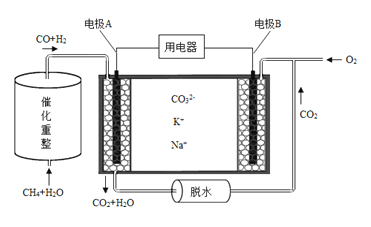
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
【答案】(1)3NA(2)c+3b-2a;
(3)①![]() mol·L-1·min·-1;②6.75;③吸热;
mol·L-1·min·-1;②6.75;③吸热;
(4)①B;②CO+3H2+4CO32――8e-=5CO2+3H2O;
【解析】试题分析:(1)在反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)中,甲烷中碳元素的化合价由-4价升高到+2价,1mol甲烷转移6mol电子,8g甲烷的物质的量为8g÷16g/mol=0.5mol,则转移的电子数为0.5mol×6×NA=3NA。
CO(g)+3H2(g)中,甲烷中碳元素的化合价由-4价升高到+2价,1mol甲烷转移6mol电子,8g甲烷的物质的量为8g÷16g/mol=0.5mol,则转移的电子数为0.5mol×6×NA=3NA。
(2)①2CO(g)+O2(g)=2CO2(g)△H1=akJ·mol-1,
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1,
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3="c" kJ·mol-1,
根据盖斯定律,③+3×②-2×①得CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4= c+3b-2akJ/mol。
CO(g)+3H2(g) △H4= c+3b-2akJ/mol。
(3)①根据题意,甲烷的最初浓度为1mol/L,经过tmin,反应达到平衡,平衡时c(CH4)=0.5mol·L-1,则反应消耗甲烷0.5mol,根据反应掉的浓度和化学计量数成正比,则反应消耗氢气为1.5mol/L,v(H2)=1.5/tmol·L-1·min·-1;②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5molL-1,氢气的浓度为1.5mol/L,CO的浓度为0.5mol/L,水蒸气的浓度为0.5mol/L,则该温度K=[c(CO)c3(H2)]÷[c(CH4)c(H2O)]= [0.5×1.53]÷[0.5×0.5]=6.75;③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,CO的浓度增大,说明平衡正反应方向移动,而升高温度,平衡向吸热反应方向移动,则该反应是吸热反应。
(4)①根据图示,CO和氢气在电极A放电发生氧化反应生成CO2和水,则电极A为负极,,电极B为正极,所以放电过程中K+和Na+向电极B移动;②该电池的负极为CO和氢气在电极放电发生氧化反应生成CO2和水,则电极反应式为CO+3H2+4CO32――8e-=5CO2+3H2O。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在共价化合物中一定含有共价键
B. 由非金属元素组成的化合物一定是共价化合物
C. 含有离子键的化合物一定是离子化合物
D. 双原子单质分子中的共价健一定是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
A. Fe2O3 B. FeCl3 C. Fe2(SO4)3 D. FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题

(1)NaClO2中Cl的化合价为________.
(2)写出“反应”步骤中生成ClO2的化学方程式.______________________________________。
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为_________、_________。最后再加入的一种试剂,其目的是__________.(用离子方程式表示)。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为_________,该反应中氧化产物是_____________.
(5)“有效氧含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为_______g.(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

(1)表中硫酸的质量分数W1为_____(不写单位,用含c1、p1的代数式表示)。
(2)物质的量浓度为c1mol· L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________ mol· L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的描述正确的是( )
A. 有7个周期,18个族
B. 第IA族元素也称为碱金属元素
C. 元素种类最多的族为第IIIB族
D. 第七周期若排满,最多可排50种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三种分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙―→甲+C的化学反应方程式_______________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________(填写序号)。
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:
写出上述第四种元素在周期表中的位置____________________________。
写出C+丙→乙+丁的化学反应方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是生产呋喃丹、好安威等农药的主要中间体,是高附加值的精细化工产品.一种以邻氯苯酚(A)为主要原料合成呋喃酚(F)的流程如下:
![]()
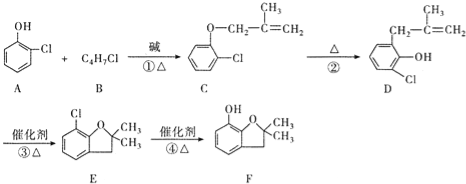
回答下列问题:
(1)A 物质核磁共振氢谱共有 个峰,④的反应类型是 ,C和D中含有的相同官能团的名称是 .
(2)下列试剂中,能和D反应的有 (填标号).
A.溴水 B.酸性K2Cr2O7溶液 C.FeC12溶液 D.纯碱溶液
(3)写出反应①的化学方程式是 (有机物用结构简式表示,下同).
(4)有机物B可由异丁烷经三步反应合成:异丁烷![]() X
X![]() Y
Y![]()
![]() 有机物B条件a为 ,Y生成B的化学方程式为 .
有机物B条件a为 ,Y生成B的化学方程式为 .
(5)呋喃酚的同分异构体很多,写出符合下列条件的所有同分异构体的结构简式
①苯环上的一氯代物只有一种
②能发生银镜反应的芳香酯.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com