
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题

(1)NaClO2中Cl的化合价为________.
(2)写出“反应”步骤中生成ClO2的化学方程式.______________________________________。
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为_________、_________。最后再加入的一种试剂,其目的是__________.(用离子方程式表示)。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为_________,该反应中氧化产物是_____________.
(5)“有效氧含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为_______g.(计算结果保留两位小数)
【答案】 +3 价 2NaClO3+SO2+H2SO4=ClO2+2NaHSO4 NaOH 溶液 Na2CO3 溶液 H++OH― =H2O 和 2H+ +CO32― =H2O +CO2↑ 2:1 O2 1.57g。
【解析】试题分析:(1)根据元素化合价代数和等于0计算NaClO2中C1的化合价;(2) 根据流程图“反应”步骤中硫酸、SO2、NaClO3反应生成ClO2、NaHSO4;(3)粗盐精制时, Mg 2+和Ca 2+分别生成氢氧化镁、碳酸钙沉淀而除去;最后再加入盐酸,其目的是除去氢氧化钠和碳酸钠;(4)根据流程图,尾气处理过程中C1O2、氢氧化钠、H2O2反应生成NaClO2,根据方程式分析氧化剂与还原剂的物质的量之比;根据化合价变化分析反应中氧化产物;(5)“有效氯含量”的定义计算NaClO2的有效氯含量。
解析:(1)根据元素化合价代数和等于0,NaClO2中钠为+1价、氧为-2价,所以C1的化合价为+3;
(2) 根据流程图“反应”步骤中硫酸、SO2、NaClO3反应生成ClO2、NaHSO4,反应方程式为2NaClO3+SO2+H2SO4=ClO2+2NaHSO4;
(3)粗盐精制时, Mg 2+和Ca 2+分别生成氢氧化镁、碳酸钙沉淀而除去,所以为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为NaOH 溶液、Na2CO3 溶液。;最后再加入过量的盐酸除去氢氧化钠和碳酸钠,反应的离子方程式是H++OH― =H2O 和 2H+ +CO32― =H2O +CO2↑;
(4)根据流程图,尾气处理过程中C1O2、氢氧化钠、H2O2生成NaClO2,反应方程式是![]() ,C1O2中氯元素化合价降低,是氧化剂,H2O2中氧元素化合价升高生成氧气,H2O2是还原剂,O2是氧化产物,所以氧化剂与还原剂的物质的量之比2:1;(5)氧化能力相同,即转移电子数相同,设NaClO2的有效氧含量为xg,则
,C1O2中氯元素化合价降低,是氧化剂,H2O2中氧元素化合价升高生成氧气,H2O2是还原剂,O2是氧化产物,所以氧化剂与还原剂的物质的量之比2:1;(5)氧化能力相同,即转移电子数相同,设NaClO2的有效氧含量为xg,则![]() ,x=1.57g。
,x=1.57g。


科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA
B. 56gN2与CO混合物中原子总数是4NA
C. 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA
D. 常温下,lLpH=1的H2SO4溶液中的H+为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)请你一起参与实验探究并回答下列问题:
Ⅰ.在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①_______________、
②_______________、
③________________。
II.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

⑴各装置连接顺序为_____ →_____ → _____ 。
⑵装置C中装有试剂的名称是_________________。
⑶能证明生成物中有CuCO3的实验现象是________________________。
Ⅲ.若蓝色沉淀中CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其中CuCO3组成:
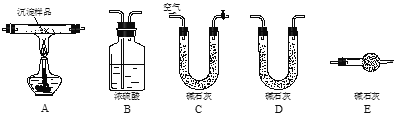
⑴ 实验开始时先要将空气通过碱石灰的目的是____________________;
实验中持续通入过量空气的作用是______________。
⑵若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
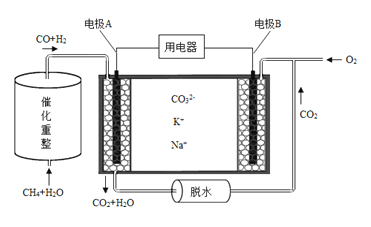
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 25℃、101KPa条件下22克CO2所含的原子数目为1.5NA
B. 标准状况下0.1molH2O含有的分子数目为0.1NA
C. 0℃、101KPa条件下03NA氧气的体积是6.72升
D. 58.5克NaCl固体中含有的离子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Mg2+、Ba2+ 、Ag+和NO3-,现分别用NaCl溶液、NaOH溶液和Na2CO3溶液将溶液中三种阳离子逐一完全沉淀分离,其流程如右图所示。下列说法正确的是( )

A. 试剂A可能为NaOH溶液
B. 沉淀2只能是BaCO3 ,不可能是Mg(OH)2
C. 每加一种试剂需过量但不需要过滤即可进行下一步
D. 生成沉淀1的离子方程式只能是:Ag+ + Cl- = AgCl↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com