
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的反应是( )
A.NH4Cl![]() NH3↑ +HCl↑
NH3↑ +HCl↑
B.2Na2O2+2CO2=2Na2CO3+O2
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.CaC2+2H2O=Ca(OH)2 +C2H2↑
【答案】B
【解析】
A. NH4Cl![]() NH3↑ +HCl↑反应物中有离子键的断裂,生成物也只有极性键生成,没有非极性共价键的断裂,没有离子键和非极性键的形成,A项错误;
NH3↑ +HCl↑反应物中有离子键的断裂,生成物也只有极性键生成,没有非极性共价键的断裂,没有离子键和非极性键的形成,A项错误;
B. Na2O2为含有非极性键的离子化合物,CO2中含有极性键,则反应物中离子键、极性共价键和非极性共价键断裂,碳酸钠中有离子键和极性共价键,氧气中有非极性共价键,所以同时有离子键、极性共价键、非极性共价键的形成,B项正确;
C. NaOH中含有离子键和极性共价键,Cl2中含有非极性共价键,则反应物中有离子键、非极性共价键和极性共价键的断裂,没有非极性共价键的生成,C项错误;
D. CaC2+2H2O=Ca(OH)2 +C2H2↑属于水解反应,CaC2有离子键的断裂,两个碳之间的非极性共价键没有断裂,在生成物乙炔中,H2O中有极性共价键的断裂,同时有离子键和极性共价键的生成,但没有非极性共价键的断裂与生成,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是

A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 下列结论正确的是
下列结论正确的是
A. 该有机物分子式为C13H16
B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线
D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.SO2通入Ba(OH)2溶液中出现白色沉淀,因为Ba2++SO2+2OH-=BaSO4↓+2H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe![]() 2Fe2+
2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O![]() Al(OH)3↓+3
Al(OH)3↓+3![]()
D.向Na2CO3溶液中滴加稀盐酸:Na2CO3+2H+![]() H2CO3+2Na+
H2CO3+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理氮氧化物(NOx)的污染是化学研究的重要课题之一。
I.NO能被灼热的铁粉还原为N2,同时生成FeO,利用下列装置模拟该反应。

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应。
(1)上述装置接口的连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)装置D的作用是___________________。
(3)装置E中反应的化学方程式为___________________。
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有_____________________。
II.实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。设计实验验证产物NaNO2既有氧化性又有还原性。
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性KMnO4溶液
(5)取适量NaNO2溶液,加入_____________,观察到_____________现象,证明其具有氧化性。
(6)参照(5),设计实验证明NaNO2有还原性________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,能随即发生剧烈反应的是(填序号,下同)____________,常温下缓慢反应(或微热后能发生剧烈反应)的是____________,常温下不反应,但加热后发生剧烈反应的是____________,加热也不发生反应的是____________。由此可以得到上述四种酸氧化性由强到弱的顺序是____________。
(2)先将铜与浓硫酸加热时反应产生的气体X持续通入如图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括____________。
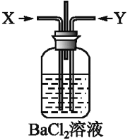
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是____________。
A.HNO3的酸性比H2SO4的强
B.盐酸的酸性比H2SO3的强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
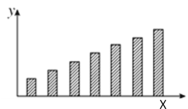
A. 若X轴为原子序数,y轴表示的可能是第一电离能
B. 若X轴为原子序数,y轴表示的可能是原子半径
C. 若X轴为最高正化合价,y轴表示的可能是电负性
D. 若X轴为族序数,y轴表示的可能是0.1mol/L最高价氧化物对应水化物溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
(2)通过K值的计算,(1)中的反应是_________反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(g),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2 | H2O | CO | H2 |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_______________________。
②在3~4min之间,反应处于___________状态(填“平衡”或“非平衡”)。
③第6min时,平衡向_________方向移动,可能的原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com