
分析 根据n=$\frac{N}{{N}_{A}}$计算出二氧化碳的物质的量,再根据二氧化碳的分子式计算出含有氧原子的物质的量;根据m=nM计算出该二氧化碳的质量,最后根据V=nVm计算出二氧化碳在标准状况下的体积.
解答 解:CO2分子数为6.02×1023,CO2的物质的量为:n(CO2)=$\frac{6.03×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,1mol CO2分子中含有O的物质的量为:1mol×2=2mol,该二氧化碳的质量为:44g/mol×1mol=44g,标准状况下1mol CO2的体积为:22.4L/mol×1mol=22.4L,
故答案为:1mol;2mol;44g;22.4L.
点评 本题考查了物质的量的简单计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数等物理量之间的关系即可解答,试题侧重基础知识的考查,培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与盐酸 | CO32-+2H+=H2O+CO2↑ | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| B | 向次氯酸钙溶液通入过量CO2 | Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 正确 |
| C | 石灰水中滴加少量NaHCO3溶液 | Ca2++HCO3-+OH-=CaCO3↓+H2O | 错误,不满足Ca(OH)2的配比 |
| D | 过量铁屑溶于稀硝酸 | 3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  量取20.00 mL Na2CO3溶液 | B. |  能证明非金属性 Cl>C>Si | ||
| C. | 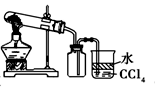 实验室制取并收集NH3 | D. | 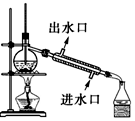 分离酒精与CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离的c(H+):①=②>③=④ | |
| B. | 将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②=③ | |
| C. | 等体积的①、②两种溶液分别与足量铝粉反应,生成H2的量相等 | |
| D. | 向等体积四种溶液中分别加水至体积为原来的100倍后,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
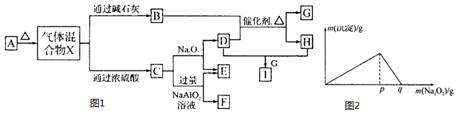
| I溶液的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| C的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
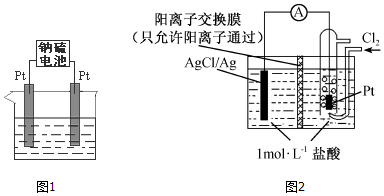
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂只有硝酸钾 | |
| B. | C即是氧化剂也是还原剂 | |
| C. | 被氧化与被还原的S的质量之比为3:2 | |
| D. | 还原产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 防止催化剂中毒 | B. | 提高反应效率 | C. | 提高SO2转化率 | D. | 防止环境污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com