
| A. | c (A-)+c (HA)=0.1mol/L | B. | c (Na+)-c (A-)=1×10-6-1×10-8mol/L | ||
| C. | c (OH-)-c (HA)=1×10-8mol/L | D. | c(Na+)>c(OH-)>c(A)>c(H+) |
分析 25℃,测得0.1mol/L的NaA溶液的pH=8,说明NaA是强碱弱酸盐,A-离子水解溶液显碱性,A-+H2O?HA+OH-,
A.依据溶液中物料守恒分析n(Na)=n(A);
B.结合溶液中离子积常数计算氢离子浓度和氢氧根离子浓度,溶液中存在电荷守恒计算判断,c(OH-)+c(A-)=c(H+)+c(Na+);
C.依据溶液中质子守恒和溶液PH、离子积常数计算,质子守恒为c(OH-)=c(H+)+c(HA);
D.NaA是强碱弱酸盐,A-离子水解溶液显碱性;
解答 解:A.依据溶液中物料守恒分析n(Na)=n(A),溶液体积相同,浓度关系为:c(Na+)=c(HA)+c(A-)=0.1mol/L,故A正确;
B.pH=8溶液中c(H+)=10-8mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L,存在电荷守恒计算判断,c(OH-)+c(A-)=c(H+)+c(Na+),c (Na+)-c (A-)=1×10-6-1×10-8mol/L,故B正确;
C.依据溶液中质子守恒和溶液PH、离子积常数计算,质子守恒为c(OH-)=c(H+)+c(HA),c (OH-)-c (HA)=c(H+)=1×10-8mol/L,故C正确;
D.NaA是强碱弱酸盐,A-离子水解溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(A)>c(OH-)>c(H+),故D错误;
故选D.
点评 本题考查了盐类水解应用,电解质溶液中电荷守恒、质子守恒,溶液PH计算分析,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.lmol氯气与铁反应,转移0.2NA电子 | |
| B. | 0.lmol过氧化钠与水反应,转移0.2NA电子 | |
| C. | 0.lmol铁与高温水蒸汽反应,转移0.3NA电子 | |
| D. | 0.lmol二氧化锰与足量浓盐酸反应,有0.4NA Cl-被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、NO3- | B. | Fe3+、K+、Br-、SCN- | ||
| C. | NH4+、Na+、CO32-、OH- | D. | Al3+、Mg2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫(俗称硫磺)是一种黄色晶体,质脆.不溶于水,易溶于酒精 | |
| B. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| C. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 | |
| D. | FeO是一种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 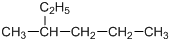 主链上的碳原子数是5 主链上的碳原子数是5 | B. |  名称是3甲基2丁烯 名称是3甲基2丁烯 | ||
| C. | 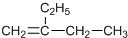 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | D. | 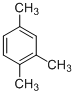 的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
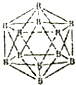 晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )
晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )| A. | 1种 | B. | 3种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com