
下列化学用语使用正确的是
A.葡萄糖、淀粉的最简式都是CH20 B.CH4的电子式是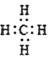
C.乙醛分子的结构简式是CH3COH D.丙烷分子的球棍模型是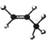
科目:高中化学 来源: 题型:
硅及其化合物在材料领域中应用广泛,下列叙述正确的是
A.硅单质是制造玻璃的主要原料
B.CaSiO3可用来制造太阳能电池
C.水泥的主要成分是Na2SiO3、CaSiO3和SiO2
D.二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
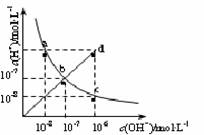
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
对于右图的锌锰电池,下列说法正确的是
A.MnO2是氧化剂,被氧化
B.碳棒为正极、锌筒为负极
C.放电过程中NH4+向锌极移动
D.负极反应为:Zn-2e-+2OH-==Zn(OH)2

查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
 请回答下列问题:
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反 应。
应。
(2)下列说法正确的是
A.该反应的反应热为:△H= 91kJ·mol-1 B.起始充入的CO为2mol
C.容器中压强恒定时,反应已达平衡状态 D..增加CO浓度,CO的转化率增大
E.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时 会减小
会减小
(3)从反应开始到建成平衡, v(H2)=________;请在“图3”中画出甲醇百分含量随温度T变化的P2曲线,且P1<P2。
(4)以甲醇、空气为主要原料,KOH溶液为电解质溶液,铂为电极构成燃料电池。则该电池中负极上的电极反应式为 。
(5)已知在常温常压下:
①H2O(g) = H2O(l) ΔH1=-44.0 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③2CH3OH(l) + 3O2(g) = 2CO2 (g) + 4H2O(g) ΔH3=-1275.6 kJ/mol
(g) + 4H2O(g) ΔH3=-1275.6 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应的实验,能够达到实验目的的是

A.实验室制取少量的硝基苯 B.证明溴乙烷、NaOH、乙醇溶液共热生成乙烯


C.分离乙酸乙酯、碳酸钠和水的混合物 D.在实验室测定中和反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
含20.0 g NaOH的稀溶液与稀盐酸完全反应时,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = +28.7 kJ·mol-1
= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = -28.7 kJ·mol-1
= -28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = +57.4 kJ·mol-1
= +57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = -57.4 kJ·mol-1
= -57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
试运用所学知识,回答下列问题:
(1)已知某反应的平衡表达式为: ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)
2NH3(g) △H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g) + D(s)ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s)ΔH,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol·L—1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
 ②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)以天然气(假设杂质不参与反应) 为原料的燃料电池示意图如图所示。
为原料的燃料电池示意图如图所示。
①放电时,负极的电极反应式为:
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为:
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素X核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关X的说法中,不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能形成化学式为NaXO3的含氧酸钠盐
C.X原子的最外层电子数和核电荷数不可能为偶数
D.X能与某些金属元素或非金属元素形成化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com