
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:

下列说法正确的是( )
A. X分子中所有原子一定在同一平面上
B. X、Y分子中均含有1个手性碳原子
C. 1molX与溴水充分反应,最多消耗Br2的物质的量为2mol
D. 1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为4mol
科目:高中化学 来源: 题型:
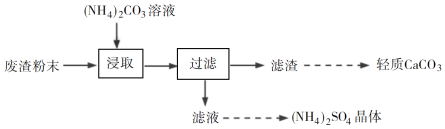
【题目】实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
(1)室温下,反应CaSO4(s)+![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)达到平衡,则溶液中
(aq)达到平衡,则溶液中 =________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
=________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为________;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是________。
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是________;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有________。

(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:______[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )

A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)![]() 4Na+O2↑
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰气分子式为(CN)2,其性质与卤素相似,在化学上称为类卤化合物,以下关于(CN)2的叙述错误的是( )
A.可与活泼金属直接发生化学反应
B.可溶于水,易溶于NaOH溶液
C.是一种无毒气体
D.可用HCN溶液与MnO2混合加热制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) ![]() 1/2N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和提高NO的转化率,采取的正确措施是
1/2N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和提高NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 升高温度同时充入N2
C. 加催化剂同时增大压强 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s) + 2NO(g) ![]() CO2(g) + N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
CO2(g) + N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是

A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 若状态B、C、D的压强分别为PB、PC 、PD ,则PC=PD>PB
D. 在T2时,若反应体系处于状态D ,则此时v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是_______,原子数之比是_______,密度之比是___________。
(2)下列所给出的几组物质中:含有分子数最多的是_______;含有原子数最多的是________;标准状况下体积最大的是________。
① 1gH2; ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com