
【题目】(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是_______,原子数之比是_______,密度之比是___________。
(2)下列所给出的几组物质中:含有分子数最多的是_______;含有原子数最多的是________;标准状况下体积最大的是________。
① 1gH2; ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为_______。
【答案】1∶1 2∶3 2∶3 ③ ② ① 5.4mL
【解析】
(1)同温同压下,相同容器的体积相同,结合阿伏加德罗定律及其推论分析解答;
(2)由N=nNA可知,n越大,分子数越多;由V=nVm可知,n越大,气体体积越大;结合物质的量及分子构成计算判断;
(3)首先根据c=![]() 计算浓硫酸的物质的量浓度,再根据配制前后溶质的物质的量不变分析计算。
计算浓硫酸的物质的量浓度,再根据配制前后溶质的物质的量不变分析计算。
(1)同温同压下的两个相同容器中分别装有O2和O3气体,气体的物质的量相同,则两瓶气体中分子数之比是1∶1,原子数之比是1×2∶1×3=2∶3,密度之比等于相对分子质量之比=32∶48=2∶3,故答案为:1∶1;2∶3;2∶3;
(2)①1gH2的物质的量为![]() =0.5mol,含有原子0.5mol×2=1mol,标准状况下的体积为0.5mol×22.4L/mol=11.2L;
=0.5mol,含有原子0.5mol×2=1mol,标准状况下的体积为0.5mol×22.4L/mol=11.2L;
②2.408×1023个CH4的物质的量为![]() =0.4mol,原子的物质的量为0.4mol×5=2mol,标准状况下体积为0.4mol×22.4L/mol=8.96L;
=0.4mol,原子的物质的量为0.4mol×5=2mol,标准状况下体积为0.4mol×22.4L/mol=8.96L;
③10.8gH2O的物质的量为![]() =0.6mol,含有原子0.6mol×3=1.8mol,标准状态下水为液态,体积约为10.8mL;
=0.6mol,含有原子0.6mol×3=1.8mol,标准状态下水为液态,体积约为10.8mL;
④标准状况下6.72LCO2的物质的量为![]() =0.3mol,含有原子0.3mol×3=0.9mol;
=0.3mol,含有原子0.3mol×3=0.9mol;
含有分子数最多的是③;含有原子数最多的是②;标准状况下体积最大的是①,故答案为:③;②;①;
(3)质量分数为98%的浓H2SO4(密度为1.84g/cm3)的物质的量浓度c=![]() =
=![]() mol/L=18.4mol/L,设质量分数为98%的浓H2SO4的体积为V,由配制前后溶质的物质的量不变,可知0.1L×1mol/L=V×18.4mol/L,解得:V=0.0054L=5.4mL,故答案为:5.4mL。
mol/L=18.4mol/L,设质量分数为98%的浓H2SO4的体积为V,由配制前后溶质的物质的量不变,可知0.1L×1mol/L=V×18.4mol/L,解得:V=0.0054L=5.4mL,故答案为:5.4mL。


科目:高中化学 来源: 题型:
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:

下列说法正确的是( )
A. X分子中所有原子一定在同一平面上
B. X、Y分子中均含有1个手性碳原子
C. 1molX与溴水充分反应,最多消耗Br2的物质的量为2mol
D. 1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某密闭容器中加入0.2 mol CO和0.2 mol H2O,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
A.缩小容器的体积,混合气体的密度不变
B.v(CO)=v(CO2)时,表明反应达到平衡状态
C.平衡时CO和H2O的转化率相等
D.无法计算该条件下反应的化学平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无水Na2SO3固体配制 250 mL 0.1000 mol·L-1溶液的步骤如下图,请回答:

(1)在配制过程中必要的仪器有:烧杯、玻璃棒、胶头滴管、天平和____________;
(2)下列操作不会使配得的Na2SO3溶液浓度偏低的是__________。
A.容量瓶刚用蒸馏水洗净,没有烘干
B.图③没有用蒸馏水洗烧杯 2-3 次,并转移洗液
C.图⑤时仰视容量瓶的刻度线
D.图⑥后,发现液面略低于刻度线,再滴加少量水使液面凹面与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程。请回答下列问题。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是________。
(3)操作Ⅰ的名称为____,简述利用“操作Ⅰ”的装置洗涤难溶物的实验操作________。
(4)化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1︰2反应可生成Cl-和一种阳离子________的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是________。
(5)常温时N2H4·H2O(水合肼)在碱性条件下能还原(4)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到________g的单质Ag。
(6)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为________,负极的产物有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知:
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
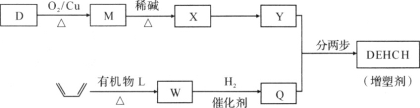
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮、硫污染物的治理是环保的一项重要工作。
(1)①N2(g)+O2(g)═2NO(g) △H1
②2C(s)+O2(g)═2CO(g) △H2
③C(s)+O2(g)═CO2(g) △H3
则2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_______________(用△H1、△H2、△H3表示)。
(2)工业上常用醋酸二氨合亚铜 [Cu(NH3) 2] AC溶液(AC为CH3COO-)来吸收某合成气中的CO,其反应为:[Cu(NH3) 2] AC(aq)+NH3(g)+CO(g) ![]() [Cu(NH3)3] AC CO(aq) △H<0常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3) 2] AC溶液的措施是________________;
[Cu(NH3)3] AC CO(aq) △H<0常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3) 2] AC溶液的措施是________________;
(3)用天然气制取H2的其原理为:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 。在密闭容器中通入物质的量均为0.1mol的CH4与CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:压强P1_____P2(填 “大于”或“小于”),理由是____________________,压强为P2时,在Y点:v(正)_________v(逆)(填“大于”、“小于”或“等于”)。
2CO(g)+2H2(g) 。在密闭容器中通入物质的量均为0.1mol的CH4与CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:压强P1_____P2(填 “大于”或“小于”),理由是____________________,压强为P2时,在Y点:v(正)_________v(逆)(填“大于”、“小于”或“等于”)。

(4)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离平衡常数Ka=9.6×10﹣4,NaNO2溶液中存在平衡NO2- +H2O![]() HNO2 +OH- 其水解平衡常数Kh=5.0×10﹣11 则该温度下水的离子积常数KW=______。
HNO2 +OH- 其水解平衡常数Kh=5.0×10﹣11 则该温度下水的离子积常数KW=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在常温下,有硫酸和盐酸的混合液20 mL,向该溶液中加入0.05 mol/L的Ba(OH)2时,生成的BaSO4沉淀的质量和混合溶液的pH有如图所示关系。计算:

①最初混合溶液中硫酸和盐酸的物质的量浓度。_____________
②A点溶液的pH值。_________________
(2)某温度时,Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,试求:
①在该某温度时AgCl的溶解度;(![]() =1.34,结果保留一位有效数字)_______________
=1.34,结果保留一位有效数字)_______________
②若把足量的AgCl固体分别放入①100 mL H2O ②100 mL 0.1 mol/L NaCl溶液 ③100 mL 0.1 mol/L AlCl3溶液 ④100 mL 0.1 mol/L MgCl2溶液,搅拌后溶解达到平衡,在相同温度下,求各溶液中Ag+浓度由大到小的顺序。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com