
【题目】一定温度下,向某密闭容器中加入0.2 mol CO和0.2 mol H2O,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
A.缩小容器的体积,混合气体的密度不变
B.v(CO)=v(CO2)时,表明反应达到平衡状态
C.平衡时CO和H2O的转化率相等
D.无法计算该条件下反应的化学平衡常数
科目:高中化学 来源: 题型:
【题目】氰气分子式为(CN)2,其性质与卤素相似,在化学上称为类卤化合物,以下关于(CN)2的叙述错误的是( )
A.可与活泼金属直接发生化学反应
B.可溶于水,易溶于NaOH溶液
C.是一种无毒气体
D.可用HCN溶液与MnO2混合加热制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①蔗糖 ②熔融NaCl ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO2 ⑦NaHSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩饱和FeCl3溶液
(1)上述物质中可导电的是_____(填序号,下同);
(2)上述物质中不能导电,但属于电解质的是_____。
(3)⑦在水溶液中的电离方程式为__________________________________。
(4)实验室制备少量Fe(OH)3胶体所用的物质有______(填序号)和蒸馏水,反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水中c(H+)=2×10﹣7 mol/L, 则此温度下水的离子积为______.若温度不变,滴入稀盐酸使c(H+)=5×10﹣4 mol/L, 则此时c(OH﹣)=________.由水电离产生的c(H+)为________,此时温度________(填“高于”、“低于”或“等于”)
(2)①25℃时,NaHSO3溶液呈_______性,原因是_______(用离子方程式结合文字回答)
②常温下,pH=9的NaOH与pH=13的NaOH等体积混合后溶液的pH=________;
(3)25℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为________。
②将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题;
(1)在新型纳米催化剂 Na-Fe3O4,和HMCM-22的表面将CO2先转化为烯烃再转化为烷烃,已知CO2转化为CO的反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol;
2 CO2 (g)+6H2(g)=C2H4(g)+4 H2O (g) △H=-128kJ/mol
则CO转化为C2H4的热化学方程式为______________________。
(2)用氨水捕捉烟气中的CO2生成NH4CO3。通常情况下,控制反应温度在35℃-40℃范围内的原因___________。
(3)有科学家提出可利用FeO吸收CO2,6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) K1(平衡常数),对该反应的描述正确的是______
2Fe3O4(s)+C(s) K1(平衡常数),对该反应的描述正确的是______
a.生成 1mol Fe3O4时电子转移总数为2NA
b.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
d.恒温恒压下,气体摩尔质量不变可作为平衡的标志
(4)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,一定条件下,向2L恒容密闭容器中充入1 molCO2和3mo1H2。在不同催化剂作用下发生反应I、反应II、反应II,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g) △H,一定条件下,向2L恒容密闭容器中充入1 molCO2和3mo1H2。在不同催化剂作用下发生反应I、反应II、反应II,相同时间内CO2的转化率随温度变化如图所示:

①活化能最小的为___________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)___________v(逆)(填“>”、“=”或“<”)。
③T4温度下该反应的衡常数___________(保留两位有效数字)
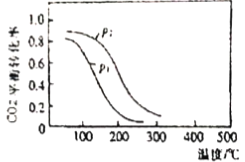
④CO2的平衡转化率与温度、压强的关系如图所示:则该反应为___________(放热反应、吸热反应);P1___________P2(填“>”、“=”或“<”)
(5)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废电池屮的铅膏(主要成PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___________(保留两位有效数字):若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将___________(填“增大”、“减小”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___________(保留两位有效数字):若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是_______,原子数之比是_______,密度之比是___________。
(2)下列所给出的几组物质中:含有分子数最多的是_______;含有原子数最多的是________;标准状况下体积最大的是________。
① 1gH2; ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D、E、X、Y、Z是周期表中的前20号元素,且原子序号逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、直线形、折线形、直线形,回答下列问题:
(1)E的氢化物的电子式为_____,D的氢化物分子中键角为_____,Y的氢化物的结构式为_____,X的氢化物沸点_____Z的氢化物沸点(填“高于”或“低于”)。
(2)D和Y形成的化合物,其分子的电子式为_____,空间构型为_____形,为_____(填“极性”或“非极性”)分子。
(3)取上述五种氢化物中的两种化合,能生成一种含有离子键、共价键和配位键的化合物,试写出其中的任意一种的化学式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com