
(14分) A、B、C、D均为短周期的非金属元素,且原子序数依次增大。A、B可形成一种极易溶于水的碱性气体X,A、B、C元素可组成离子晶体,该晶体的化学式为A4B2C3;A和D可形成极易溶于水的酸性气体Y,X分子比Y分子少8个电子
(1)请写出四种元素的元素符号:A B  C D
C D
(2)用离子方程式表示A4B2C3的水溶液显酸性的原因
(3)用电子式表示B2 用电子式表示ADC
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
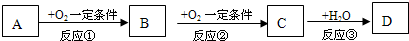
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
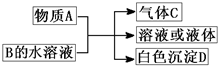 (2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| +O2 |
| +O2 |
| +H2O |
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
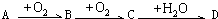 .以下推断不正确的是( )
.以下推断不正确的是( )| A、若A为溶于CS2的淡黄色固体单质,且D为强酸,则B通常用品红试剂来检验 | B、若A为喷泉实验常用的气体且其水溶液呈碱性,则D能与A反应制化肥 | C、若C为温室气体,则A与C在一定条件下反应可生成B | D、若B、C对环境造成的危害主要是光化学烟雾等,则A不可能是单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com