

| c(H +)?c(F -) |
| c(HF) |
| c(H +)?c(F -) |
| c(HF) |


科目:高中化学 来源: 题型:
| △ |
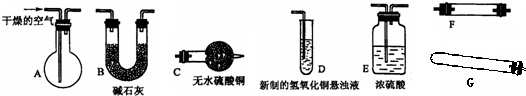
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、回收并合理处理废电池 |
| B、将煤转化为水煤气作燃料 |
| C、发电厂的煤经脱硫处理 |
| D、电镀废液经中和后直接排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.48L | B、5.6L |
| C、6.72L | D、8.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)随着温度的升高而降低 |
| B、在35℃时,纯水中 c(H+)>c(OH-) |
| C、水的电离常数K(25℃)>K(35℃) |
| D、水的电离是一个吸热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤中含有单质碳、苯、二甲苯、焦炉气 |
| B、煤的干馏是物理变化 |
| C、煤由复杂的有机物和无机物组成,煤的干馏是化学变化 |
| D、煤主要含有碳和氢两种元素,同时还含有少量的硫、氧、氮等元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
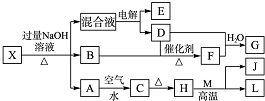 有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略).其中,B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体.在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热.
有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略).其中,B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体.在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com