
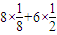 =4,
=4, =12,
=12,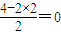 ,价层电子对为2,所以CS2分子为直线形.
,价层电子对为2,所以CS2分子为直线形.

科目:高中化学 来源: 题型:
 化学-物质结构
化学-物质结构查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:福建省厦门六中2011-2012学年高二上学期期中考试化学理科试题 题型:022
Ⅰ、
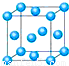
氯化铬酰(CrO2Cl2)在有机合成中可作(1)写出铬原子的基态电子排布式________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________(填元素符号),其中一种金属的晶胞结构如下图所示,该晶胞中含有金属原子的数目为________.
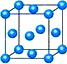
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子.
(3)在①苯
②CH3OH
③HCHO
④CS2
⑤CCl4
⑥CH3Cl
⑦HCOOH七种有机物质中,碳原子采取sp2杂化的分子有________(填序号),CS2![]() 分子的空间构型是________.
分子的空间构型是________.
Ⅱ、不锈钢是由铁、铬、镍、碳及众多不同元素所组![]() 成的合金.
成的合金.
(1)基![]() 态碳(C)原子的价电子排布式为________.
态碳(C)原子的价电子排布式为________.
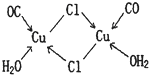
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr3+的配位数为________;[Cr(H2O)4Cl2]Cl中含有的化学键为________.
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423 K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是________,Ni(CO)4易溶于________(填序号).
A.水
B.四氯化碳
C.苯
D.硫酸镍溶液
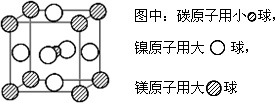
(4)据报道,只含镁、镍和碳三![]() 种元素的晶体竟然具有超导性.鉴于这三种元素都是常见元素,从而引起广泛关注.该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式________.晶体中
种元素的晶体竟然具有超导性.鉴于这三种元素都是常见元素,从而引起广泛关注.该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式________.晶体中![]() 每个镁原子周围距离最近的镍原子有________个.
每个镁原子周围距离最近的镍原子有________个.
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com