
实验室制取少量干燥的氨气涉及下列装置中,其中正确的是( )

A.①是氨气发生装置 B.③是氨气发生装置
C.②是氨气吸收装置 D.④是氨气收集、检验装置
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
下列有关有机物的说法正确的是
A.等物质的量的甲烷和氯气的混和气体长时间光照,最后得到的有机物只有CH3Cl
B.烯烃跟氢气起加成反应产物是2,2,3,4-四甲基戊烷,则这样的烯烃有3种
C.有机物(CH3)3CCH2OH不能发生催化氧化
D.有机物
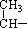 CH2
CH2 的单体为丙烯,链节为
的单体为丙烯,链节为
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加
2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。

查看答案和解析>>
科目:高中化学 来源: 题型:
铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:

(1)滤液A加过量NaOH离子方程式表示为
____________________________________________________________________________
(2)灼烧时盛放药品的仪器名称是____________________。
(3)步骤IV中发生反应的化学方程式是 。
(4)步骤Ⅲ中生成固体C的离子反应方程式为
_________________________________________________________________________。
(5)取滤液B 100 mL,加入1 mol·L-1盐酸200 mL,沉淀量达到最大且质量为11.7 g。则滤液B中c(AlO )=_________,c(Na+)________6 mol·L-1(填“>”、“=”或“<”)。
)=_________,c(Na+)________6 mol·L-1(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
A.Mg和Al的总质量为9g
B.最初20mLNaOH溶液用于中和过量的稀硫酸
C.NaOH溶液物质的量浓度为5mol·L-1
D.生成的氢气在标准状况下的体积为11.2L

查看答案和解析>>
科目:高中化学 来源: 题型:
下图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1。B为常见液体。

试回答下列问题:
(1)X是__________________; F是___________________。
(2)A D反应的化学方程式并标出电子转移的方向和数目_______________________________。
(3)G与Cu的反应中,G表现_______________________性质。
(4)X与过量NaOH溶液反应的离子方程式: 。
(5)以C、B、D为原料可生产G,若使a mol C 完全转化为G,理论上至少需要D ____________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中,由加成反应引起的是( )
A.往溴水中加入四氯化碳溶液,水层褪色 B.往溴的四氯化碳溶液中通入乙烯,溶液褪色。
C.一定条件下,将苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成
D. 将乙醇蒸汽通过灼热的氧化铜,固体颜色由黑色变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
(1)填写下表中的空格(结果保留一位小数)。
| ① V(NaOH)(mL) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 |
| ②溶液的pH | 1.0 | 2.3 | 3.3 | 4.3 | 7 | 9.7 | 10.7 |
 (2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图。
(2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图。
(3)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、氧化还原滴定等。某学生测定食用精制盐中的碘含量(食盐中加入一定量的KIO3)。
已知:I2+2S2O32-=2 I-+S4O62-,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液15.00 mL,恰好反应完全。
①配平化学方程式 KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
②判断c中反应恰好完全依据的现象是 。
③根据以上实验,所测精制食盐中的碘含量是 mg/kg。(以含w的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com