
下图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1。B为常见液体。

试回答下列问题:
(1)X是__________________; F是___________________。
(2)A D反应的化学方程式并标出电子转移的方向和数目_______________________________。
(3)G与Cu的反应中,G表现_______________________性质。
(4)X与过量NaOH溶液反应的离子方程式: 。
(5)以C、B、D为原料可生产G,若使a mol C 完全转化为G,理论上至少需要D ____________mol 。
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
(1)a点时,v(正) ▲ v(逆)(填“<”、“>”或“=”),X线、Y线中代表N2O4的是 ▲ ;
(2)反应在第10 min达到平衡,则前10 min内用NO2表示的化学反应速率v(NO2)= ▲ mol·L-1·min-1。该温度下,反应的平衡常数K= ▲ (可用分数表示);
(3)在第25分钟,进行的操作是 ▲ ;
(4)a、b、c、d四点对应的时刻,NO2物质的量浓度由小到大的顺序是 ▲ ,再次平衡时的d点NO2的体积分数比b点时 ▲ (填“大”、“小”或“相等”);
(5)假如在第35分钟从容器中移去0.4mol N2O4,并加入适当催化剂使反应在第40分钟达到平衡,请在图⑴中画出从第35分钟以后两种物质的物质的量浓度c随时间t的变化关系,并标注所画线条对应的物质。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作完全正确的是
| 实验 | 操作 | |
| A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中 |
| B | 配制500mL一定浓度的氯化钾溶液 | 准确称取氯化钾固体,放入到500 mL的容量瓶中,加水溶解、振荡、定容、摇匀 |
| C | 闻氯气法的方法 | 用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
| D | 分离出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取少量干燥的氨气涉及下列装置中,其中正确的是( )

A.①是氨气发生装置 B.③是氨气发生装置
C.②是氨气吸收装置 D.④是氨气收集、检验装置
查看答案和解析>>
科目:高中化学 来源: 题型:
用1L1mol·L-1NaOH溶液吸收0.6molCO2,所得溶液中Na2CO3和NaHCO3的物质的量之比约为( )
A、2︰3 B、1︰2 C、2︰1 D、3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的能量最高的电子层的符号为 ,该电子层具有的原子轨道数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞平均拥有8个硅原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,同时产生一种可使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,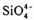 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si与O的原子数之比为 化学式为 。
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si与O的原子数之比为 化学式为 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确地是( )
A.一个氮原子的质量就是氮的相对原子质量
B.一个碳原子的质量约为1.99×10-23g
C.氧气的摩尔质量在数值上等于它们的相对分子质量
D.氢氧化钠的摩尔质量是40g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com