
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的能量最高的电子层的符号为 ,该电子层具有的原子轨道数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞平均拥有8个硅原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,同时产生一种可使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,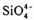 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si与O的原子数之比为 化学式为 。
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si与O的原子数之比为 化学式为 。
 |
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加
2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。

查看答案和解析>>
科目:高中化学 来源: 题型:
下图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1。B为常见液体。

试回答下列问题:
(1)X是__________________; F是___________________。
(2)A D反应的化学方程式并标出电子转移的方向和数目_______________________________。
(3)G与Cu的反应中,G表现_______________________性质。
(4)X与过量NaOH溶液反应的离子方程式: 。
(5)以C、B、D为原料可生产G,若使a mol C 完全转化为G,理论上至少需要D ____________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中,由加成反应引起的是( )
A.往溴水中加入四氯化碳溶液,水层褪色 B.往溴的四氯化碳溶液中通入乙烯,溶液褪色。
C.一定条件下,将苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成
D. 将乙醇蒸汽通过灼热的氧化铜,固体颜色由黑色变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
A. 元素W和M的某种单质可作为水处理中的消毒剂 B.由元素M和Z只能形成一种化合物
C.元素Y、Z、W的单质晶体属于同种类型的晶体 D. X、M两种元素只能形成X2M型化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol/L的NaOH溶液中Na+的物质的量为1 mol
B.28g乙烯所含共用电子对数目为4NA
C.常温常压下,32g O2与O3的混合气体中含有的原子总数为2NA
D.1mol 苯中含有碳碳双键的数目为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的操作中,不能达到目的的是
A.除去苯中的少量溴:加入NaOH溶液后分液
B.除去乙烷中的少量乙烯:通入溴水中洗气
C.除去CO2中的少量HCl气体:通过盛有饱和NaHCO3溶液的洗气瓶
D.除去FeCl2溶液中的少量FeCl3:加入足量铜粉后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
(1)填写下表中的空格(结果保留一位小数)。
| ① V(NaOH)(mL) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 |
| ②溶液的pH | 1.0 | 2.3 | 3.3 | 4.3 | 7 | 9.7 | 10.7 |
 (2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图。
(2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图。
(3)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、氧化还原滴定等。某学生测定食用精制盐中的碘含量(食盐中加入一定量的KIO3)。
已知:I2+2S2O32-=2 I-+S4O62-,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液15.00 mL,恰好反应完全。
①配平化学方程式 KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
②判断c中反应恰好完全依据的现象是 。
③根据以上实验,所测精制食盐中的碘含量是 mg/kg。(以含w的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
R原子序数是15,下列关于R元素的说法中,错误的是:
A.R的最高正化合价是+5 B.R是第二周期第ⅤA族的元素
C. R的氢化物分子式是RH3 D.R的最高价氧化物对应的水化物的水溶液呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com