

| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氨气通入稀硫酸溶液中 NH3+H+=NH4+ |
| B、二氧化碳通入碳酸钠溶液中 CO2+CO32-+H2O=2 HCO3- |
| C、硫酸铝溶液跟偏铝酸钠溶液反应 Al3++3 AlO2-+6H2O=4Al(OH)3↓ |
| D、氯气通入冷的氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
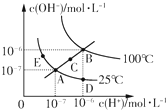
| A、图中五点KW间的关系:B>C>A=D=E |
| B、若从D点到A点,可采用在水中加入少量酸的方法 |
| C、若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法 |
| D、若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为
(1)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
 露天烧烤不仅产生大量有害气体污染环境,而且在烧焦的肉类中还含有强烈的致癌物:苯并芘,其结构简式如图:
露天烧烤不仅产生大量有害气体污染环境,而且在烧焦的肉类中还含有强烈的致癌物:苯并芘,其结构简式如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 9.4 |
| c(H+)c(CH3COO-) |
| c(CH3COOH) |
| 17.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C、将①、④混合,若c(CH2COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com