
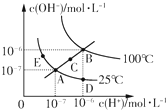
| A、图中五点KW间的关系:B>C>A=D=E |
| B、若从D点到A点,可采用在水中加入少量酸的方法 |
| C、若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法 |
| D、若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、V1>V2 |
| B、V1<V2 |
| C、V1=V2 |
| D、V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅠA族的元素都为金属元素 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、过渡元素全部是金属元素 |
| D、周期表中有7个主族,7个副族,一个0族,一个Ⅷ族,共16个族16个纵行 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 有机物的结构可用“键线式”简化表示,如:CH3-CH=CH-CH3可表示为
有机物的结构可用“键线式”简化表示,如:CH3-CH=CH-CH3可表示为 ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com