
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( ) 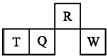
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.T的最高价氧化物对应的水化物不能和强碱反应
【答案】D
【解析】解:由短周期元素R、T、Q、W所处的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素. A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性N>Si,非金属性越强,氢化物越稳定,故氢化物的稳定性:NH3>SiH4 , 故A正确;
B.同周期自左而右非金属性增强,非金属性Si<S,非金属性越强,最高价含氧酸的酸性越强,所以酸性:H2SiO3<H2SO4 , 故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:T>Q>R,故C正确;
D.T的最高价氧化物对应的水化物为氢氧化铝,属于两性氢氧化物,能与强酸、强碱反应,故D错误,
故选D.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
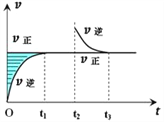
A. Z和W在该条件下一定不为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积恒定的密闭容器中,进行如下可逆反应:2A(g)+B(s)![]() C(g)+D(g)。当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是( )
C(g)+D(g)。当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是( )
①容器内混合气体的密度②容器内混合气体的压强③容器内混合气体的总物质的量④容器内C物质的物质的量浓度
A. ①④ B. ②③
C. ②③④ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能成功的是( )
A.将铁屑、溴水、苯混合制溴苯 B.苯和硝基苯采用分液的方法分离
C.聚乙烯使酸性KMnO4溶液退色 D.用水鉴别:苯、乙醇、四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤) 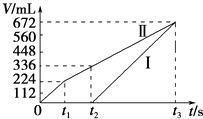
(1)原混合溶液中CuSO4的物质的量浓度.
(2)电解至t3时,消耗水的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32 g/mol。面出编号为2的原子结构示意图:_________。
(2)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1mol NH3和O2时的能量变化值为382.5 lkJ,达到平衡后此反应NH3生成量与温度的实验数据如下表所示。则该反应的热化学方程式为______。
T/K | 303 | 301 | 323 |
NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
(3)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:2 NH4+ (aq)+Mg(OH)2(s)![]() Mg2+( aq)+ 2NH3·H2O( aq)
Mg2+( aq)+ 2NH3·H2O( aq)
写出上述反应的平衡常数表达式______________。
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验:
实验① | 等体积1mol/L氨水和0.1 mol/LMgCl2溶液混合 | 生成白色沉淀 |
实验② | 等体积0.1mol/L氨水和l mol/LMgCl2溶液混合 | 无现象 |
请结合平衡常数表达式分析实验①②产生不同现象的原因:_____________________。
(4)在室温下,化学反应I- (aq)+ClO-( aq)=IO-( aq)+Cl-( aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
实验编号 | I-的初始浓度( mol·L-1) | ClO-的初始浓度( mol·L-1) | OH-的初始浓度( mol·L-1) | 初始速率v(mol·L-1··s-1) |
1 | 2×10-3 1.5×10-3 | 1.00 | 1.8×10-4 | |
2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
已知表中初始反应速率与有关离子浓度关系可以表示为:v=kc(I-)c(ClO-)bc(OH-)c(温度一定时,k为常数)。
①设计实验2和实验4的目的是_________;
②计算b、c的值:b=________,c=_______;
③若实验编号4的其他浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=_____mol·L-l·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 葡萄糖和麦芽糖均可发生水解
B. 淀粉和蛋白质遇碘均变为蓝色
C. 从海水中可以得到MgCl2,可电解MgCl2溶液制备Mg
D. 燃煤中加入适量石灰石,可减少废气中SO2的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com