
����Ŀ����1��M�����ֶ�����Ԫ����ɣ�ÿ��M���Ӻ���18�����ӣ���������ģ����ͼ��ʾ�����M��Ħ������Ϊ32 g/mol��������Ϊ2��ԭ�ӽṹʾ��ͼ��_________��
��2���ڳ��³�ѹ���������£�N2�ڴ���(TiO2)������H2O��Ӧ������1mol NH3��O2ʱ�������仯ֵΪ382.5 lkJ���ﵽƽ���˷�ӦNH3���������¶ȵ�ʵ���������±���ʾ����÷�Ӧ���Ȼ�ѧ����ʽΪ______��
T/K | 303 | 301 | 323 |
NH3��������(10-1mol) | 4.3 | 5.9 | 6.0 |
��3������Һ�У�һ��Ũ�ȵ�NH4+���ܽⲿ��Mg(OH)2���壬��Ӧ���£�2 NH4+ (aq)+Mg(OH)2(s)![]() Mg2+( aq)+ 2NH3��H2O( aq)
Mg2+( aq)+ 2NH3��H2O( aq)
д��������Ӧ��ƽ�ⳣ������ʽ______________��
ij�о���ѧϰС��Ϊ̽��Mg2+��NH3��H2O��Ӧ�γɳ���������������������ʵ�飺
ʵ��� | �����1mol��L��ˮ��0.1 mol��LMgCl2��Һ��� | ���ɰ�ɫ���� |
ʵ��� | �����0.1mol��L��ˮ��l mol��LMgCl2��Һ��� | ������ |
����ƽ�ⳣ������ʽ����ʵ��٢ڲ�����ͬ�����ԭ��_____________________��
��4���������£���ѧ��ӦI- (aq)+ClO-( aq)=IO-( aq)+Cl-( aq)�ķ�Ӧ���ʼŨ�ȡ���Һ�е����������ӳ�ʼŨ�ȼ���ʼ���ʼ�Ĺ�ϵ���±���ʾ��
ʵ���� | I-�ij�ʼŨ��( mol��L-1) | ClO-�ij�ʼŨ��( mol��L-1) | OH-�ij�ʼŨ��( mol��L-1) | ��ʼ����v(mol��L-1����s-1) |
1 | 2��10-3 1.5��10-3 | 1.00 | 1.8��10-4 | |
2 | a | 1.5��10-3 | 1.00 | 3.6��10-4 |
3 | 2��10-3 | 3��10-3 | 2.00 | 1.8��10-4 |
4 | 4��10-3 | 3��10-3 | 1.00 | 7.2��10-4 |
��֪���г�ʼ��Ӧ�������й�����Ũ�ȹ�ϵ���Ա�ʾΪ��v=kc(I-)c(ClO-)bc(OH-)c(�¶�һ��ʱ��kΪ����)��
�����ʵ��2��ʵ��4��Ŀ����_________��
�ڼ���b��c��ֵ��b=________��c=_______��
����ʵ����4������Ũ�Ȳ��䣬������Һ�����ֵ���ΪpH=13����Ӧ�ij�ʼ����v=_____mol��L-l��s-1��
���𰸡� ![]() 2N2 (g)+ 6H2O(1)=4NH3 (g) +3O2 (g) ��H=+1 530.0 kJ/mol
2N2 (g)+ 6H2O(1)=4NH3 (g) +3O2 (g) ��H=+1 530.0 kJ/mol ![]() ��ƽ�ⳣ������ʽ���Կ�������c(NH3��H2O)��((Mg2+)�ı���ͬ�ij̶�ʱ��c2 (NH3��H2O)�Գ������ɵ�Ӱ����� ̽��ClO-��Ũ�ȱ仯�Գ�ʼ��Ӧ���ʵ�Ӱ�� 1 -1 7.2��10��3
��ƽ�ⳣ������ʽ���Կ�������c(NH3��H2O)��((Mg2+)�ı���ͬ�ij̶�ʱ��c2 (NH3��H2O)�Գ������ɵ�Ӱ����� ̽��ClO-��Ũ�ȱ仯�Գ�ʼ��Ӧ���ʵ�Ӱ�� 1 -1 7.2��10��3
����������1�����������ƶϣ�M�����к���4����1��ԭ�Ӻ�2����2��ԭ�ӣ���M�����ֶ�����Ԫ����ɡ�ÿ��M���Ӻ���18�����ӣ���1��ֻ��ΪHԭ�ӡ�2ΪNԭ�ӣ�����MΪN2H4����ԭ�ӵĺ˵����Ϊ7����ԭ�ӽṹʾ��ͼΪ![]() ����2�����ݱ������ݿ�֪�������¶ȣ����������ʵ������ӣ�ƽ�����ƣ�˵������Ӧ�����ȷ�Ӧ������ԭ���غ��֪�Ȼ�ѧ����ʽΪ2N2 (g)+ 6H2O(1)��4NH3 (g) +3O2 (g) ��H=+1 530.0 kJ/mol����3���������ʲ���д��ƽ�ⳣ������ʽ����÷�Ӧ��ƽ�ⳣ����K��c(Mg2+)c2(NH3H2O)/c2(NH4+) ������ƽ�����ʽ���Կ�������c(NH3��H2O)��c(Mg2+)�ı���ͬ�ij̶ȣ�c2 (NH3��H2O)�Գ������ɵ�Ӱ���������c��Mg2+��c2��OH-����Ksp[Mg��OH��2]��������c��Mg2+��c2��OH-����Ksp[Mg��OH��2]������ʵ��١��ڲ���������ͬ����4���ٸ��ݿ��Ʊ�����ƶԱ�ʵ��ԭ��ʵ��1��2��Ŀ����̽��I-��Ũ�ȱ仯�Գ�ʼ��Ӧ���ʵ�Ӱ�죬ʵ��2��4��Ŀ����̽��ClO-��Ũ�ȱ仯�Գ�ʼ��Ӧ���ʵ�Ӱ�����ڽ�ʵ��1��ʵ��4�����ݷֱ����v=kc(I-)c(ClO-)bc(OH-)c�ɵ�b��1��ͬ����ʵ��3��ʵ��4���й����ݴ���v=kc(I-)c(ClO-)bc(OH-)c�ɵ�c����1����pH��13����c(OH��)��0.1mol/L������v��kc(I-)c(ClO-)bc(OH-)c��kc(I-)c(ClO-)b����0.1����1������Ϊkc(I-)c(ClO-)b����1����1��7.2 �� 10�C4�����v��7.2��10-3 mol��L-l��s-1��
����2�����ݱ������ݿ�֪�������¶ȣ����������ʵ������ӣ�ƽ�����ƣ�˵������Ӧ�����ȷ�Ӧ������ԭ���غ��֪�Ȼ�ѧ����ʽΪ2N2 (g)+ 6H2O(1)��4NH3 (g) +3O2 (g) ��H=+1 530.0 kJ/mol����3���������ʲ���д��ƽ�ⳣ������ʽ����÷�Ӧ��ƽ�ⳣ����K��c(Mg2+)c2(NH3H2O)/c2(NH4+) ������ƽ�����ʽ���Կ�������c(NH3��H2O)��c(Mg2+)�ı���ͬ�ij̶ȣ�c2 (NH3��H2O)�Գ������ɵ�Ӱ���������c��Mg2+��c2��OH-����Ksp[Mg��OH��2]��������c��Mg2+��c2��OH-����Ksp[Mg��OH��2]������ʵ��١��ڲ���������ͬ����4���ٸ��ݿ��Ʊ�����ƶԱ�ʵ��ԭ��ʵ��1��2��Ŀ����̽��I-��Ũ�ȱ仯�Գ�ʼ��Ӧ���ʵ�Ӱ�죬ʵ��2��4��Ŀ����̽��ClO-��Ũ�ȱ仯�Գ�ʼ��Ӧ���ʵ�Ӱ�����ڽ�ʵ��1��ʵ��4�����ݷֱ����v=kc(I-)c(ClO-)bc(OH-)c�ɵ�b��1��ͬ����ʵ��3��ʵ��4���й����ݴ���v=kc(I-)c(ClO-)bc(OH-)c�ɵ�c����1����pH��13����c(OH��)��0.1mol/L������v��kc(I-)c(ClO-)bc(OH-)c��kc(I-)c(ClO-)b����0.1����1������Ϊkc(I-)c(ClO-)b����1����1��7.2 �� 10�C4�����v��7.2��10-3 mol��L-l��s-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ������������ԭ�����͵���
����H2��I2������HI��ɵ�ƽ����ϵ��ѹ����ɫ����
�����ű���ʳ��ˮ���ռ�Cl2
�۸�ѹ�ȳ�ѹ ��������ߺϳɰ��IJ���
�ܸ����ºϳɰ����ʽϿ�
�ݹ�ҵ��ȡ������Na(l)+ KCl(l) ![]() NaCl(l)+ K(g)ѡ���˵��¶�,ʹK�������ӷ�Ӧ������з������
NaCl(l)+ K(g)ѡ���˵��¶�,ʹK�������ӷ�Ӧ������з������
A. �ڢۢ� B. �٢ڢۢ� C. �٢ڢۢܢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������T������������������������ȣ������жϲ���ȷ���ǣ� �� 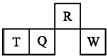
A.�����̬�⻯������ȶ��ԣ�R��Q
B.����������Ӧˮ��������ԣ�Q��W
C.ԭ�Ӱ뾶��T��Q��R
D.T������������Ӧ��ˮ���ﲻ�ܺ�ǿ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ֧����Ϊ25.00mL�ĵζ��ܣ���Һ����8.00mL��������Һȫ����������Һ������Ϊ�� ��
A.����17.00mLB.����8.00mLC.����17.00mLD.����8.00mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijһ���º�ѹ�����з������·�Ӧ��A(g)+B(g)![]() 2C(g)+D(g)��H<0��t1ʱ�̴ﵽƽ�����t2ʱ�̸ı�ijһ�������䷴Ӧ������ͼ������˵����ȷ����
2C(g)+D(g)��H<0��t1ʱ�̴ﵽƽ�����t2ʱ�̸ı�ijһ�������䷴Ӧ������ͼ������˵����ȷ����

A. t2ʱ�̸ı���������������ܱ������м�C
B. I��II�����̴ﵽƽ��ʱ��A���������I >II
C. 0~t2ʱ��V��>V��
D. I��II�����̴ﵽƽ��ʱ��ƽ�ⳣ��I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һһ�������Ե���
A.ʹ������Һ�ʻ�ɫ����ҺB.c(H+)= c(OH-)=10-6mol/L ��Һ
C.pH=7 ����ҺD.�����ǡ����ȫ��Ӧ�������ε���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����£�ij��̬��1���ֻ����1��������������ӳɷ�Ӧ����������飬1 mol����������4 mol Cl2������ȫȡ����Ӧ��������Ľṹ��ʽΪ(����)
A. CH2==CH2 B. CH3CH==CH2
C. CH3CH3 D. CH2==CH��CH==CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֽ�����ĩ�������������������Һ�����˺�����Һ�м���������ռ���Һ���ٹ��ˣ���Һ�д������ڵ�������
A. Fe3+B. AlO2-C. Al3+D. Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������Ƽ���ϵ���У����н�����ȷ����
A. �����������������µ���Ҫԭ���Ƿŵ�ʱN2��O2�ϳ���NO
B. ά����D�ܴٽ�����ԸƵ�����
C. ��̼����������й¶��ԭ��ʱ�����˻�ѧ�仯
D. ���������Ľ������֬���������Ǹ߷�������С���ӵĹ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com