
【题目】一支量程为25.00mL的滴定管,若液面在8.00mL处,将溶液全部放下来,液体的体积为( )
A.大于17.00mLB.大于8.00mLC.等于17.00mLD.等于8.00mL
科目:高中化学 来源: 题型:
【题目】下列实验能成功的是( )
A.将铁屑、溴水、苯混合制溴苯 B.苯和硝基苯采用分液的方法分离
C.聚乙烯使酸性KMnO4溶液退色 D.用水鉴别:苯、乙醇、四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤) 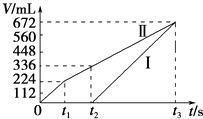
(1)原混合溶液中CuSO4的物质的量浓度.
(2)电解至t3时,消耗水的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol甲烷和4mol氯气组成的混合气体充入到大试管中将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,一段时间后,推测可能观察到的现象
①黄绿色逐渐消失
②试管壁上有油珠
③试管内水面上升
④水槽内有少量晶体析出
A.只有①③ B.只有①②③ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32 g/mol。面出编号为2的原子结构示意图:_________。
(2)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1mol NH3和O2时的能量变化值为382.5 lkJ,达到平衡后此反应NH3生成量与温度的实验数据如下表所示。则该反应的热化学方程式为______。
T/K | 303 | 301 | 323 |
NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
(3)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:2 NH4+ (aq)+Mg(OH)2(s)![]() Mg2+( aq)+ 2NH3·H2O( aq)
Mg2+( aq)+ 2NH3·H2O( aq)
写出上述反应的平衡常数表达式______________。
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验:
实验① | 等体积1mol/L氨水和0.1 mol/LMgCl2溶液混合 | 生成白色沉淀 |
实验② | 等体积0.1mol/L氨水和l mol/LMgCl2溶液混合 | 无现象 |
请结合平衡常数表达式分析实验①②产生不同现象的原因:_____________________。
(4)在室温下,化学反应I- (aq)+ClO-( aq)=IO-( aq)+Cl-( aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
实验编号 | I-的初始浓度( mol·L-1) | ClO-的初始浓度( mol·L-1) | OH-的初始浓度( mol·L-1) | 初始速率v(mol·L-1··s-1) |
1 | 2×10-3 1.5×10-3 | 1.00 | 1.8×10-4 | |
2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
已知表中初始反应速率与有关离子浓度关系可以表示为:v=kc(I-)c(ClO-)bc(OH-)c(温度一定时,k为常数)。
①设计实验2和实验4的目的是_________;
②计算b、c的值:b=________,c=_______;
③若实验编号4的其他浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=_____mol·L-l·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5,依次发生的分解反应:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com