
【题目】(一)、 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:

(1)降低温度,SO2的转化率_________,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(二) 在一个固定体积的密闭容器中,充入 2 mol A 和1 mol B,发生如下反应:2 A(g) + B(g)![]() 3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为_____反应(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是____________(用序号填空)
① 4 mol A + 2 mol B ② 3 mol C + 1 mol D + 1 mol B
③ 3 mol C + 2 mol D ④ 1.6 mol A + 0.8 mol B + 0.6 mol C
【答案】增大 减小 15~20 min,25~30 min 增加了O2的量 ab 吸热 ③
【解析】
(一)(1)该反应正反应为放热反应,降低温度平衡向正反应方向移动,二氧化硫转化率增大,降低温度反应速率减小,故答案为:增大;减小;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,故答案为:15-20min和25-30min;
(3)由图可知,反应进行至20 min时,氧气的浓度突然增大,二氧化硫和三氧化硫的浓度不变,说明改变的条件是增加了O2的量;由图可知,反应向正反应方向进行,10min到15min反应混合物单位时间内的物质的量的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变。a.加了催化剂,增大反应速率,故a正确;b.缩小容器体积,增大压强,增大反应速率,故b正确;c.降低温度反应速率降低,故c错误;d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d错误;故选ab;故答案为:增加了O2的量;ab;
(二)(1)根据质量守恒定律及反应方程式知,2 A(g) + B(g)![]() 3C(g) + D(s)反应前后气体的物质的量不变,气体的质量变小,所以平均摩尔质量减小,温度升高,平衡时混合气体的平均相对摩尔质量减小,说明平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热;
3C(g) + D(s)反应前后气体的物质的量不变,气体的质量变小,所以平均摩尔质量减小,温度升高,平衡时混合气体的平均相对摩尔质量减小,说明平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热;
(2)维持容器体积和温度不变,根据等效平衡,把物质都换算成方程式一边的物质,且和初始加入的入2molA和1molB相等即可。①4molA+2molB与初始A、B的物质的量不同,故错误;②3molC+lmolD+1molB换算成A、B,A、B的物质的量分别为2mol、2mol,与A、B的初始物质的量不同,故错误;③3molC+2molD换算成A、B,A、B的物质的量分别为2mol、1mol,D是固体,对气体无影响,与A、B的初始物质的量相同,故正确;④1.6molA+0.8 molB+0.6mol C换算成A、B,与A、B的初始物质的量不同,故错误;故答案为:③。


科目:高中化学 来源: 题型:
【题目】含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增的A、B、C、D、E五种元素,其中只有E是第四周期元素,A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)E的+2价离子基态核外电子排布式为_______。
(2)A、B、C、D原子中,电负性最大的是_______(元素符号)
(3)1 mol B2A4分子中σ键的数目为______。B4A6为链状结构,其分子中B原子轨道的杂化类型只有一种,则杂化类型为_______。
(4)C的简单氢化物在D 的简单氢化物中具有很大的溶解度,其主要原因是______。
(5)E和C形成的一种化合物的晶胞结构如图所示,该化合物的化学式为______。
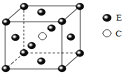
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明一氧化碳具有还原性,有人设计了下列实验:
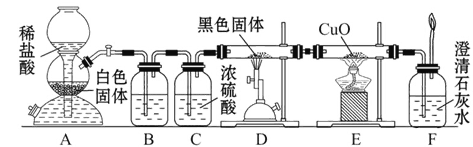
(1)装置A中生成的主要产物是___________________________________________。
(2)装置D中发生反应的化学方程式是___________________________________。
(3)必须用装置C吸收除去气体中水蒸气的理由是_________________________。
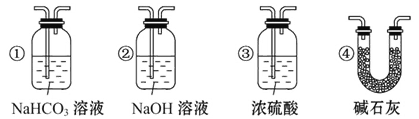
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置______与______之间连接下列装置中的______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)在密闭容器中,保持一定温度进行如下反应:N2(g)+3H2(g) ![]() 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填序号)。
A. N2的转化率越高 B. NH3的产量越大
C. 正反应进行得越彻底 D. 化学反应速度越快
(3)a与b的关系是:a ____ b(填>、<、=)
(二)在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
① | 升高温度 | ______ |
② | 再充入a mol H2 | _______ |
③ | 将容器容积扩大为原来2倍 | _______ |
④ | 容积不变通入b mol Ne(g) | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是实验室制取和收集氨气的装置图。回答下列问题:
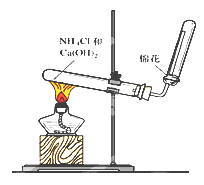
(1)写出实验室制取氨气的化学方程式__________________
(2)图中用于加热的仪器名称是___________该实验发生装置中的试管口略低于试管底的原因是____________________
(3)用蘸有浓盐酸的玻璃棒靠近收集氨气的试管管口,当观察到_____________现象时,可证明氨气已收集满。
(4)用_______________试剂干燥氨气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验,装置B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置。
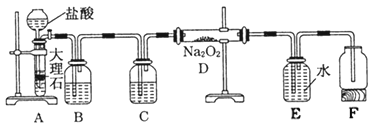
(1)C中盛有________,目的是________。
(2)写出装置D中发生反应的化学方程式___________。
(3)指出装置E的错误___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100 mL溶液进行实验:已知:
,现取三份100 mL溶液进行实验:已知:![]() + OH-
+ OH-![]() NH3↑ + H2O
NH3↑ + H2O
(1)第一份:加入AgNO3溶液有沉淀产生;
(2)第二份:加足量NaOH溶液加热后,收集到气体0.04 mol;
(3)第三份:加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A.K+的浓度为0.2 mol/LB.100 mL溶液中含0.01 mol ![]()
C.Cl-可能存在D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中位置,用化学用语回答下列问题:
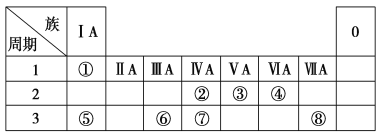
(1)④、⑤、⑥的原子半径由大到小的顺序是________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种具有漂白性的化合物的电子式:________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.KMnO4 c.Na2SO3 d.Fe2(SO4)3
(5)用电子式表示①与③组成的最简单的化合物的形成过程:_________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com