
【题目】根据物质结构和元素周期表的相关知识回答下列问题:
I.用A+、B-、C2-、D表示含有18个电子的离子或分子。请填空:
(1)A元素是__________,B元素是__________,C元素是__________。(用元素符号表示)
(2)物质D由两种元素组成,每个分子中含有三个原子,其分子式是________,电子式是______________。
Ⅱ.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
回答下列问题:
(1)Y在元素周期表中的位置为______________,
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______________ (写化学式),非金属气态氢化物还原性最强的是______________(写化学式)。
(3)Y和Z的两元素之间形成的原子个数比为1:1的化合物的电子式为______________。
【答案】K Cl S H2S ![]() 第二周期第ⅥA族 HClO4 H2S
第二周期第ⅥA族 HClO4 H2S ![]()
【解析】
I.18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等;
Ⅱ.X、Y、Z、M、G五种元素分属三个不同短周期,且原子序数依次增大,所以X为第一周期元素,为氢元素,Y、M同主族,可形成MY2、MY3两种分子,则Y为氧元素,M为硫元素,G为氯元素,X、Z同主族,可形成离子化合物ZX,则Z为钠元素,据此答题。
(1)A+的核内质子数=核外电子数+电荷数=18+1,则该元素是K元素;B-的核内质子数=核外电子数-电荷数=18-1=17,则该元素是Cl元素;C2-的核内质子数=核外电子数-电荷数=18-2=16;
答案:K Cl S
(2)物质D由两种元素组成,每个分子中含有三个原子,应该是第三周期元素的气态氢化物,确定为硫化氢;
答案: H2S ![]()
Ⅱ.由上面分析可知:X为H、Y为O、Z为Na、M为S、G为Cl;
(1)Y为氧元素,在元素周期表中的位置为第二周期第ⅥA族;
答案:第二周期第ⅥA族
(2)非金属性越强,最高价氧化物水化物酸性越强;非金属性越弱,气态氢化物还原性越强;非金属性比较:O>Cl>S;
答案:HClO4 H2S
(3)Y和Z的两元素之间形成的原子个数比为1:1的化合物是Na2O2,电子式为![]() ;
;
答案:![]()


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】从柑橘中炼制萜二烯![]() ,下列有关它的推测,不正确的是
,下列有关它的推测,不正确的是
A. 分子式为C10H16 B. 常温下为液态,难溶于水
C. 能使酸性高锰酸钾溶液褪色 D. 1mol萜二烯能与4mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为![]() ,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
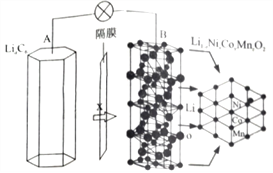
A. 允许离子X通过的隔膜属于阴离子交换膜
B. 充电时,A 为阴极,Li+被氧化
C. 可从无法充电的废旧电池的石墨电极中回收金属锂
D. 放电时,正极反应式为 Li1-aNixCoyMnzO2+aLi ++ae-= LiNixCoyMnzO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 甲是碱性氧化物,乙是酸性氧化物
C. 甲、乙可能都有漂白性,其漂白原理相同
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧,钠的氧化产物: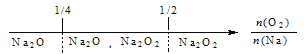
B. 铁在Cl2中燃烧,铁的氧化产物:![]()
C. NH3与Cl2反应,反应产物: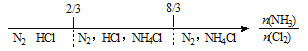
D. FeBr2溶液中通入Cl2,铁元素存在形式: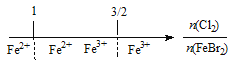
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应、产生白雾和带有制激性气味的气体。实验室合成SOCl2的原理为:SO2+Cl2+SCl2 ![]() 2SOCl2,部分装置如图所示。
2SOCl2,部分装置如图所示。

回答下列问题:
(1)仪器a 的名称是_______,装置b 的作用是__________。
(2)实验室制取SOCl2 时,所选仪器的连接顺序是⑥→______→①②←_____(某此仪器可以多次使用)。
(3)冷凝管口③是_____(填“进水”或“出水”)口,本实验中制备氯气的离子方程式为___________。
(4)将SOCl2 与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因________。
(5)已知SCl2 的沸点为50℃。实验结束后,将三颈烧瓶中的混合物分离开的实验操作名称是___。若反应中消耗标准状况下的Cl2的体积为1120 mL,最后得到纯净的SOCl26.76 g,则SOCl2 的产率为________(保留三位有效数字)。
(6)已知:SOCl2 +4NaOH= Na2SO3+2NaCl +2H2O。请设计简单的实验(可选试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸钡溶液、硝酸银溶液、品红溶液) 来验证氯化亚砜与NaOH 溶液反应后的溶液中存在Cl-__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
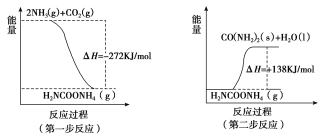
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________________________。
(2)已知反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为____________,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 ___________。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_____________________,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=_________(溶液电解前后体积的变化忽略不计)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com