
【题目】下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
科目:高中化学 来源: 题型:
【题目】下列三种有机物是某些药物中的有效成分:
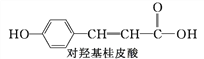
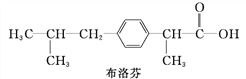
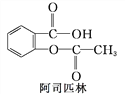
以下说法中正确的是( )
A. 三种有机物都能与浓溴水发生反应
B. 三种有机物苯环上的氢原子若被氯原子取代,则其一氯代物都只有2种
C. 将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠溶液最多
D. 用NaOH溶液和NaHCO3溶液都能鉴别出这三种有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。
⑴CaSO4·2H2O脱水反应相关的热化学方程式为:
CaSO4·2H2O(s)=CaSO4·![]() H2O(s)+
H2O(s)+![]() H2O(g) ΔH1=83.2 kJ·mol-1
H2O(g) ΔH1=83.2 kJ·mol-1
CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1
H2O (g)=H2O(l) ΔH3=-44 kJ·mol-1
则反应CaSO4·![]() H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ ![]() H2O(g)的ΔH4=_________kJ·mol-1。
H2O(g)的ΔH4=_________kJ·mol-1。
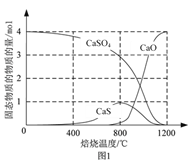
⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
①以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如图1所示。在低于800 ℃时主要还原产物为___________;高于800 ℃时主要发生的反应的化学方程式为___________。
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如下图2所示。CaCl2的作用是___________;当温度高于1200 ℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___________。

③以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100 ℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是___________。
⑶利用反应CaSO4(s)+(NH4)2CO3(aq)![]() CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构和元素周期表的相关知识回答下列问题:
I.用A+、B-、C2-、D表示含有18个电子的离子或分子。请填空:
(1)A元素是__________,B元素是__________,C元素是__________。(用元素符号表示)
(2)物质D由两种元素组成,每个分子中含有三个原子,其分子式是________,电子式是______________。
Ⅱ.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
回答下列问题:
(1)Y在元素周期表中的位置为______________,
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______________ (写化学式),非金属气态氢化物还原性最强的是______________(写化学式)。
(3)Y和Z的两元素之间形成的原子个数比为1:1的化合物的电子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用如图装置可验证同主族元素非金属性的变化规律
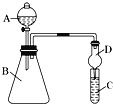
(1)仪器A的名称为______________,干燥管D的作用是______________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,装置C中的实验现象为淀粉溶液变蓝,写出使淀粉溶液变蓝的离子方程式__________________________________________。
(3)实验室中现有药品:①稀盐酸 ②稀硫酸 ③Na2SiO3溶液 ④Na2CO3 ⑤CaCO3固体,请选择合适药品设计实验验证C、Si、S的非金属性的变化规律;装置A、B中所装药品分别为_______、____________。(填序号)
Ⅱ.试用Zn+Cu2+===Zn2++Cu的反应设计原电池。
(1)原电池中使用的电解质溶液是__________________;
(2)写出电极反应式:负极:___________________________;正极______________________________;
(3) 当导线中有6.02×1023个电子通过时,电池负极质量减少____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16.三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子.有关判断不正确的是( )
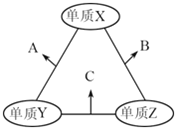
A. X元素位于ⅥA族 B. A不能溶解于B中 C. B的沸点高于C的沸点 D. A和C不可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)
A. 此反应中水既不是氧化剂又不是还原剂
B. 试管内溶液中溶质的物质的量浓度为1/22.4mol/L
C. 溶液体积占试管容积的三分之二
D. 若将试管中的气体换为氯化氢或者氨气,则水充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+![]() S↓+2I2+2H2O ii.I2+2H2O+SO2
S↓+2I2+2H2O ii.I2+2H2O+SO2![]() SO42- +4H++2I-
SO42- +4H++2I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
下列说法不正确的是( )
A. 水溶液中SO2歧化反应方程式为3SO2+2H2O ![]() 2H2SO4 +S↓
2H2SO4 +S↓
B. II是I的对比实验,则a=0.4
C. 比较I、II、III,可得出的结论是:I是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
D. 实验表明,SO2的歧化反应速率IV>I,原因是反应i比ii快;IV中由反应ii产生的H+使反应i加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com