
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
【答案】MgCO3+2H+=Mg2++CO2↑+H2OH2O2+2Fe2++2H+=2Fe3++2H2OFe(OH)3COc d3S+6OH-![]() 2S2-+SO32-+3H2O
2S2-+SO32-+3H2O
【解析】
根据流程分析可知,以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁,菱镁矿加入硫酸溶解,过滤得到的溶液中含有亚铁离子和镁离子,滤液中加入过氧化氢氧化亚铁离子为铁离子,调节溶液pH为4,使铁离子全部沉淀,过滤得到滤渣2为氢氧化铁沉淀,滤液经处理得当纯净的氧化镁。
(1)MgCO3 与稀硫酸反应的化学方程式为MgCO3+2H+=Mg2++CO2↑+H2O,故答案为:MgCO3+2H+=Mg2++CO2↑+H2O;
(2)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(3)酸溶后过滤得到溶液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液pH使铁离子全部沉淀,过滤后得到的沉淀为氢氧化铁,故答案为:Fe(OH)3;
(4)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集;
①D中收集的气体可以是CO,故答案为:CO;
②C中溶液用于吸收CO2,B中盛放的溶液是吸收二氧化硫,可以是KMnO4溶液或稀硝酸,故答案为:cd;
③A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为:3S+6OH-![]() 2S2-+SO32-+3H2O,故答案为:3S+6OH-
2S2-+SO32-+3H2O,故答案为:3S+6OH-![]() 2S2-+SO32-+3H2O。
2S2-+SO32-+3H2O。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
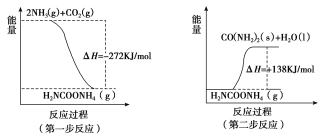
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________________________。
(2)已知反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为____________,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 ___________。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_____________________,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=_________(溶液电解前后体积的变化忽略不计)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。

下列各表述与示意图一致的是
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图①中使用的NaOH的浓度为2mol/L
C. 图②中物质A反应生成物质C,△H>0
D. 图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) ______mol CO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)0.4 mol SiH4分子中所含原子数与_________g HCl分子中所含原子数相等。
(3)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(4)等物质的量O2和臭氧(O3),其质量之比为____。若O2和O3质量相等,则其原子数之比为__________。
(5)200毫升含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl-1.5 mol,K+和Na+共1.5 mol,Mg2+为0.5 mol,则SO42-的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把11.2 g铁加入到500 mL盐酸中,在标准状况下放出氢气的体积是3.36 L,盐酸的物质的量浓度是( )
A.0.2 mol·L-1B.0.3 mol·L-1C.0.4 mol·L-1D.0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、MgO少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
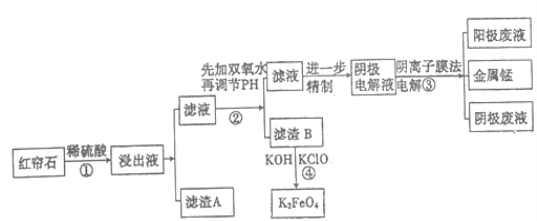
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________________________________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_________________________。
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________ L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 在水玻璃溶液中通入少量CO2:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
B. 向0.1L5mol·L-1亚硫酸氢铵溶液中逐滴加入0.1L7mol·L-1 NaOH溶液:2NH![]() +5HSO3-+7OH-===2NH3·H2O+5SO
+5HSO3-+7OH-===2NH3·H2O+5SO![]() +5H2O
+5H2O
C. Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
D. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=AlO2-+2H2O+4NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com