
【题目】(1) ______mol CO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)0.4 mol SiH4分子中所含原子数与_________g HCl分子中所含原子数相等。
(3)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(4)等物质的量O2和臭氧(O3),其质量之比为____。若O2和O3质量相等,则其原子数之比为__________。
(5)200毫升含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl-1.5 mol,K+和Na+共1.5 mol,Mg2+为0.5 mol,则SO42-的物质的量浓度为__________________。
【答案】1.5 36.5 6.72L 2.8g 2:3 1:1 2.5mol/L
【解析】
(1)根据水分子的数目求出O原子的物质的量,再根据O原子的物质的量求出二氧化碳的物质的量;
(2)根据SiH4的物质的量计算原子的物质的量,再根据原子的物质的量计算HCl的物质的量,最后计算HCl的质量;
(3)设甲烷和一氧化碳的物质的量,根据标准状况下体积和为8.96 L列方程,根据质量和为7.6g列方程,解方程组即可。
(4)等物质的量的气体质量比等于摩尔质量之比;O2和O3都是由O原子构成,质量相同的O2和O3原子数相同;
(5)根据电荷守恒计算SO42-的物质的量,根据![]() 计算浓度。
计算浓度。
(1)1.806×1024个H2O分子的物质的量是1.806×1024÷6. 02×1023=3mol,氧原子的物质的量是3mol,1个CO2分子中含有2个O原子,所以1.5mol CO2中含有3mol氧原子;
(2)0.4 mol SiH4分子中所含原子的物质的量是0.4 mol×5=2mol,1molHCl含有2mol原子,1molHCl的质量是1mol×36.5g/mol=36.5g。
(3)设甲烷和一氧化碳的物质的量分别为xmol、ymol,则![]() ,解得
,解得![]() ,所以甲烷的体积为0.3 mol×22.4L/mol=6.72L;一氧化碳的质量为0.1mol×28g/mol=2.8g。
,所以甲烷的体积为0.3 mol×22.4L/mol=6.72L;一氧化碳的质量为0.1mol×28g/mol=2.8g。
(4)等物质的量的气体质量比等于摩尔质量之比;等物质的量O2和臭氧(O3)质量比为32:48=2:3;O2和O3都是由O原子构成,质量相同的O2和O3原子数比为1:1;
(5)根据电荷守恒,SO42-的物质的量为(1.5 mol+0.5 mol×2-1.5 mol)÷2=0.5mol,SO42-的物质的量浓度为0.5mol÷0.2L=2.5mol/L。


科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16.三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子.有关判断不正确的是( )
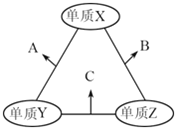
A. X元素位于ⅥA族 B. A不能溶解于B中 C. B的沸点高于C的沸点 D. A和C不可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH![]() CH3COO-+H+K1=1.75×10-5△H1>0
CH3COO-+H+K1=1.75×10-5△H1>0
CH3COO-+H20![]() CH3COOH+OH-K2=5.71×10-10△H2>0
CH3COOH+OH-K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
A. 温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小
B. 对混合溶液进行微热,K1增大、K2减小
C. 调节混合溶液的pH值至中性,则此时溶液中c(Na+)>c(CH3COO-)
D. 已知水的离子积为Kw,则三者关系为K1·K2=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的电离方程式:H2O = H++ OH-
B. pH=7的溶液一定是中性溶液
C. 升高温度,水的电离程度增大
D. 将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液A时,溶液的导电性的变化趋势如图(Ⅱ)所示。
(Ⅰ)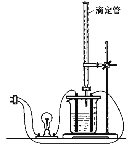 (Ⅱ)
(Ⅱ)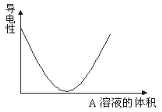
(1)滴加液体至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,可能的原因是______________。
(2)试根据离子反应的特点分析,溶液A中含有的溶质可能是(填序号)____________。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
(3)已知0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式_______________________________。
②NaHSO4属于________(填“酸”、“碱”或“盐”)。
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_______;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:_________。写出NaHSO4溶液与NaHCO3溶液混合的离子方程式_________。
(4)有以下物质:①石墨; ②氯化氢气体; ③酒精; ④铝; ⑤二氧化碳; ⑥碳酸氢钠固体;⑦氢氧化钡溶液; ⑧液态醋酸; ⑨氯化银固体; ⑩氨气。
①其中能导电的是:____________________________;
②属于非电解质的是:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度为2.59 g·L-1,其分子式为 ( )
A. C2H6B. C4H10C. C4H8D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中〔已知NaAlO2与CO2反应生成Al(OH)3〕,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)设NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 1 mol甲苯含碳碳双键的数目为3NA
B. 56 g纯铁粉与稀硝酸反应生成NO的分子数为NA
C. 25 ℃,1 L pH=13的氢氧化钡溶液中含OH-的数目为0.2NA
D. 标准状况下,11.2 L一氯甲烷含共价键的数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com