
| A. | 原子半径由大到小的顺序:Z、W、Y | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、R | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | R的最高价氧化物对应的水化物化学式一定是HRO4 |
分析 X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水,应氢氧化铝与强酸、强碱反应,可推知Z为Na元素、W为Al元素,工业上常用电解熔融氧化铝的方法冶炼Al单质;X元素最低负价绝对值与W元素最高正价相等,X处于VA族,原子序数小于Al,故X为N元素;Y、R原子最外层电子数相等,若Y为O,则R为S,若Y为F,则R为Cl,据此解答.
解答 解:X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水,应氢氧化铝与强酸、强碱反应,可推知Z为Na、W为Al,工业上常用电解熔融氧化铝的方法冶炼Al单质;X元素最低负价绝对值与W元素最高正价相等,X处于VA族,原子序数小于Al,故X为N元素;Y、R原子最外层电子数相等,若Y为O,则R为S,若Y为F,则R为Cl.
A.Y为O或F,Z为Na,W为Al,同周期随原子序数增大,原子半径减小,电子层越多半径越大,所以原子半径由大到小的顺序:Z、W、Y,故A正确;
B.X、Y为同周期元素,Y的非金属性强于X,故氢化物稳定性Y>X,故B错误;
C.金属性Al<Na,故碱性:氢氧化铝<氢氧化钠,故C错误;
D.R为S时,最高价氧化物对应水化物为H2SO4,故D错误.
故选A.
点评 本题考查原子结构和元素周期律,侧重考查学生分析推断能力,推断元素是解题的关键,注意Y、R元素的不确定性,明确元素周期律即可解答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
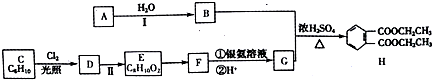
 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
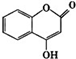 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成: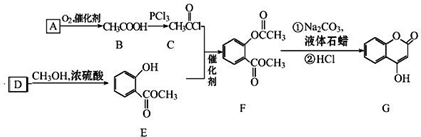
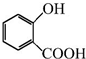 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$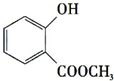 +H2O;
+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
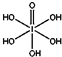 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
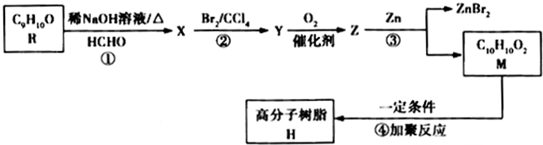
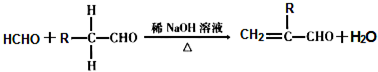
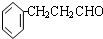 .
.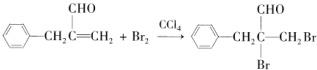 .
.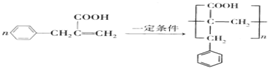 .
.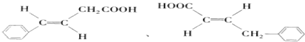 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
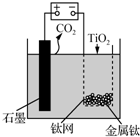 用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )
用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )| A. | 电解过程中,Ca2+向阳极移动 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱是Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离程度 | B. | 醋酸的电离常数 | ||
| C. | 中和时所需NaOH的物质的量 | D. | CH3COOH的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com