
【题目】工业上常采用吸收-电解联合法除去天然气中的H2S气体,并转化为可回收利用的单质硫,其装置如下图所示。通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率即可保证装置中反应的连续性。下列说法正确的是

A. 与电源a端相连的碳棒为阳极,气体A为O2
B. 与电源b端相连的碳棒上电极反应为:2H2O+2e-=2OH-+H2↑
C. 通电过程中,右池溶液中的OH-通过阴离子膜进入左池
D. 在通电前后,右池中的c(NaOH)与c(Na2S)之比基本不变
【答案】D
【解析】
根据图中信息可知,右侧通入含有H2S杂质的甲烷气,得到除杂后的甲烷气,结合题意,则右端碳棒为电解池的阳极,左端碳棒为阴极,阴极上水电离出的H+得电子被还原为H2,电极反应式为2H2O+2e-=2OH-+H2↑。右池中相当于H2S发生氧化反应而被除去,则溶液中c(NaOH):c(Na2S)基本保持不变。
A. 与电源a端相连的碳棒为阴极,气体A为H2,选项A错误;
B. 与电源b端相连的碳棒为阳极,电极上硫离子失电子产生硫单质,电极反应为:S2- -2e-=S↓,选项B错误;
C. 通电过程中,右池溶液中的S2-通过阴离子膜进入左池,选项C错误;
D. 在通电前后,右池中的c(NaOH)与c(Na2S) 之比基本不变,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )
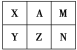
A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国稀土资源丰富。下列有关稀土元素![]() Sm与
Sm与![]() Sm的说法正确的是( )
Sm的说法正确的是( )
A. ![]() Sm与
Sm与![]() Sm的质量数相同
Sm的质量数相同
B. ![]() Sm与
Sm与![]() Sm互为同位素
Sm互为同位素
C. ![]() Sm与
Sm与![]() Sm是同一种核素
Sm是同一种核素
D. ![]() Sm与
Sm与![]() Sm核外电子数和中子数都为62
Sm核外电子数和中子数都为62
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是
A. 用氨水溶解氢氧化铜沉淀:Cu2++ 4NH3·H2O![]() [Cu(NH3)4]2+ + 4H2O
[Cu(NH3)4]2+ + 4H2O
B. NaHCO3溶液与NaAlO2溶液混合后产生白色沉淀:HCO3- + AlO2-+ H2O![]() Al(OH)3↓+ CO32-
Al(OH)3↓+ CO32-
C. 用稀硝酸清洗试管内壁的银镜:3Ag + 4H++ NO3-![]() 3Ag++ NO↑+ 2H2O
3Ag++ NO↑+ 2H2O
D. 用NaOH溶液除去镁粉中含有的杂质铝:2Al+ 2OH-+ 2H2O![]() 2AlO2-+ 3H2↑
2AlO2-+ 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向[H+]=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中[H+]=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A. 该温度高于25 ℃
B. 所得溶液中,由水电离出来的H+的浓度为1×10-11mol·L-1
C. 加入NaHSO4晶体抑制水的电离
D. 该温度下,此NaHSO4溶液与某pH=11的Ba(OH)2溶液混合后溶液呈中性,则消耗的NaHSO4溶液与Ba(OH)2溶液的体积比为100:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的叙述正确的是( )
①钠在空气中燃烧生成氧化钠
②金属钠可以保存在煤油中
③钠与硫酸铜溶液反应,可以置换出铜
④金属钠有强还原性
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价
A.①②④B.②③⑤C.①④⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。分子式为CnH2n+2的烃分子中碳碳间共用电子对数为_________,分子式为CnH2n-6的烃分子中碳碳间共用电子对数为________;
(2)相对分子质量为128的烃的分子式为_______________、_______________等;
(3)已知碳原子数小于或等于6的单烯烃与HBr反应,加成产物只有一种结构,符合此条件的单烯烃有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是




甲 乙 丙 丁
A. 图甲表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH
B. 图乙表示常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲线
C. 图丙表示反应CH4(g)+H2O (g)![]() CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
D. 图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com