
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )
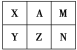
A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
【答案】B
【解析】
由短周期元素在周期表的位置可知,A为第二周期元素,A元素原子的最外层电子数比其电子层数的3倍还多,A的电子层数为2,最外层电子数为7,A应为F元素,则X为O元素,M为Ne元素,Y为S元素,Z为Cl元素,N为Ar元素,结合元素对应的单质、化合物的性质以及元素周期律的递变规律解答该题。
由上述分析可知,X为O,A为F,M为Ne,Y为S,Z为Cl,N为Ar,则
A.氧元素的单质不能燃烧,为助燃剂,A错误;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则X、Y、Z三种元素中S元素形成的单核阴离子半径最大,B正确;
C.O、F无正价,最高价氧化物对应的水化物酸性最强的是Cl元素,C错误;
D.氟气通入NaCl溶液中,F2与水反应生成HF与O2,不能置换出氯,不能证明F、Cl非金属性的相对强弱,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
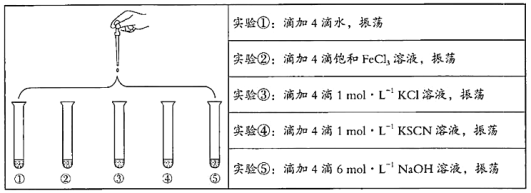
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)![]() C4H8(g)+H2(g)
C4H8(g)+H2(g) ![]() H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[ ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
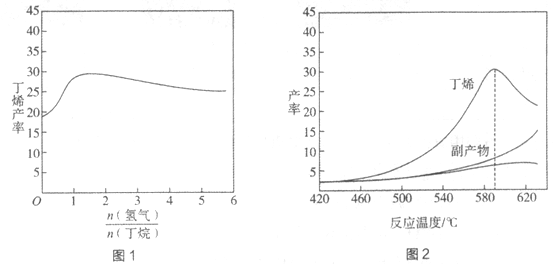
下列分析正确的是
A. 氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
B. 丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C. 随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
D. 一定温度下,控制进料比[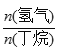 ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图为: | |
| 有机物X的相对分子质量是________。 |
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 | 有机物X的分子式是______。 |
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。 | 有机物X的结构简式是__________。 |
II.写出与![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是
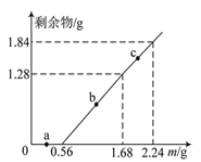
A. a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()
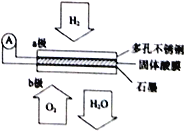
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为2 mol·L-1的盐酸V L,欲使其浓度变为4 mol·L-1,以下列出的方法中可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 蒸发掉0.5V L水
D. 加入10 mol·L-1盐酸0.6V L,再将溶液稀释至2V L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常采用吸收-电解联合法除去天然气中的H2S气体,并转化为可回收利用的单质硫,其装置如下图所示。通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率即可保证装置中反应的连续性。下列说法正确的是

A. 与电源a端相连的碳棒为阳极,气体A为O2
B. 与电源b端相连的碳棒上电极反应为:2H2O+2e-=2OH-+H2↑
C. 通电过程中,右池溶液中的OH-通过阴离子膜进入左池
D. 在通电前后,右池中的c(NaOH)与c(Na2S)之比基本不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com