
��֪�� 2Fe2+ + Br2=2Fe3++ 2Br-��Cl2+2Br-= Br2+2Cl-
�ں�n mol FeBr2����Һ�У�ͨ��Cl2����x mol Cl2������Ӧ��
��1����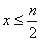 ʱ����Ӧ�����ӷ���ʽΪ_________________________
ʱ����Ӧ�����ӷ���ʽΪ_________________________
��2������Ӧ�����ӷ���ʽΪ��3Cl2+2Fe2+ +4Br-=2Br2+2Fe3+ +6Cl- ʱ��x��n�Ĺ�ϵΪ_____
��3����Fe2+��Br-ͬʱ������ʱ��x��n�Ĺ�ϵ��_______________
��4����x=nʱ����Ӧ��������������ʵ���Ϊ________________
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���жԽ���������Ʒ�ķ�����ʩ�У�������ǣ�������
| �� | A�� | ��Cr��Ni�Ƚ������뵽��ͨ�����Ƴɲ������ |
| �� | B�� | ͨ������գ���������Ʒ���������Ĥ |
| �� | C�� | ���������������ƷҪ����ˢ������ |
| �� | D�� | ���������ˮˢȥ���������ۣ����ڳ�ʪ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʷ������ȷ����ǣ� ��
| �� | �� | �� | ���������� | |
| A | ���� | ���� | �ռ� | �������� |
| B | �ռ� | ���� | ʳ�� | һ����̼ |
| C | ��ˮ | ���� | ʯ��ʯ | ������̼ |
| D | ���Լ� | ̼�� | ���� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����е�����������ʱ����Ӧ����(�¶ȡ���Ӧ��������)�ı䣬����������������ı���ǣ� ��
A��Na��O2 B��NaOH��CO2 C��Na2O2��CO2 D��C��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������أ�K2FeO4����һ�����͡���Ч�����ˮ������������ˮ��Ӧ�Ļ�ѧ����
ʽ�ǣ�4K2FeO4+10H2O=4Fe(OH)3�����壩+3O2��+8KOH ��ҵ�����Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���һ������KOH�Ϳ��Ƶø�����ء��Ʊ��������Ƶ����ַ�������Ҫ��Ӧԭ�����£�
ʪ���Ʊ���2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
�ɷ��Ʊ���2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2��
�����й�˵�����������ǣ� ��
A��������ش���ˮʱ��������ط�����ԭ��Ӧ
B��ʪ����ÿ����1mol Na2FeO4��ת��3mol����
C���ɷ���ÿ����1mol Na2FeO4��ת��4mol����
D��K2FeO4����ˮʱ��������ɱ������ʹ�������ʳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ұ���������������Ȼ����ʶ�IJ����������չ�����н����У�����ʵ�ֹ�ҵұ������ ( ).
A���� B��ͭ C���� D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����(����)
A������������������������ͭ���ɺ�ɫ��������ͭ(Cu2O)
B�����顢�����Ҵ���������һ�������¶��ܷ���ȡ����Ӧ
C����ë����˿�����������Ȼ�߷��Ӳ��ϵ���Ҫ�ɷֶ��ǵ�����
D������ͼ���������Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ֻ�м��뻹ԭ�����ܷ���ת������ �� ��
A��KMnO4��MnO2 B��HNO3��NO
C��Cl2��Cl- D��SO2��Na2SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���ش��й����⣺
|
��2��ȡ����������ĸ�Ũ����ʱ�������������в�����ȡ��
���Ķ��ٶ��仯���� �� ��
A����Һ���ܶ� ����B����Һ��H2SO4�����ʵ���
C����Һ��Ũ�� D����Һ��SO42������Ŀ
��3��ʵ������ֻ�����м��ֹ�������ƿ��100 mL��200 mL��250 mL��500 mL��ijѧ�������ϡ���Ũ���������ˮ����180 mL���ʵ���Ũ��Ϊ0.46 mol•L��1��ϡ���ᡣ
�� ����ƿ����������������е�
A���¶� ��B���̶��� ��C������ ��D��ѹǿ ��E��Ũ��
�� �����в�����д����������������ȷ�IJ���˳������ĸ�����ʾ��ÿ����ĸֻ����һ�Σ� ������������������ ��
A������ ��ˮ��ʹ��Һ��Һ��ǡ����̶�������
B���Ǻ�����ƿ��ƿ�������µߵ�ҡ��
C��������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���1~2 cm��
D����30mLˮϴ���ձ��Ͳ�����2��3�Σ���ÿ��ϴ��Һ��ע�뵽����ƿ�У�������
E��������ȴ�������ز���������ע�뵽����ƿ��
F������Ͳȷ��ȡŨ���� mL���������뵽ʢ��ˮ��Լ40 mL�����ձ��У��ò��������Ͻ��裬ʹ���Ͼ���
�� �����ƹ����У�����ʵ�������������ϡ��������ʵ���Ũ���к�Ӱ�죿���ں������ƫ�ߡ�����ƫ�͡�������Ӱ�족����
���ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ
����ʱ���ӿ̶���
����Һע������ƿǰû����ȴ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com