
����Ŀ��ij��ѧ��ȤС����ʵ����ͨ������ͼ��ʾװ���Ʊ�Na2S2O3��

��1��װ��a��ʢװNa2SO3���������������________��
��2��װ��b��������_______��
��3��ʵ�������,װ��d�е�������NaOH��Na2CO3����������________(�ѧʽ)��
��4��װ��c�з�Ӧ�Ļ�ѧ����ʽΪ_____________��
��5��ʵ�������װ��c����Һ��������Ҫ��Na2S2O3��������Na2CO3��Na2SO3�ȳɷݡ�Ϊ��֤��Na2CO3�Ĵ��ڣ��������ʵ�顣��ѡ�Լ�:AƷ����Һ��B���Ը��������Һ��C BaCl2��Һ��D����ʯ��ˮ��E ϡ����
�� ȡC����Һ�������μ�����___________(���Լ���ţ���
�� ������������������ͨ��________(���Լ���š���ʵ������ͽ���Ϊ_______��
���𰸡���1��Բ����ƿ��1�֣���2��������ȫƿ����������2�֣�
��3��Na2SO3��2������4��Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2��2����
��5����E��2�֣���B��A��D KMnO4��Һ��ɫ��dz��Ʒ����Һ����ɫ������ʯ��ˮ����ǣ���C��Һ�к���Na2CO3����4�֣�
��������
�����������1�����������Ĺ����ص��֪��װ��a��ʢװNa2SO3���������������Բ����ƿ��
��2������װ�ÿ�֪��aװ�����Ʊ�SO2�ģ�cװ�����Ʊ�Na2S2O3�ģ���װ��b��������������ȫƿ����������
��3������Ӧ����SO2ʣ�࣬SO2��NaOH��Һ��Ӧ����Na2SO3��ˮ������ʵ�������,װ��d�е�������NaOH��Na2CO3����������Na2SO3��
��4��װ��c����Na2CO3��Na2S�Ļ��Һ��ͨ��SO2������Ӧ����Na2S2O3��CO2����Ӧ�Ļ�ѧ����ʽΪNa2CO3+2Na2S+4SO2=3Na2S2O3+CO2��
��5��װ��c����Һ��������Ҫ��Na2S2O3��������Na2CO3��Na2SO3�ȳɷݣ�Ҫ֤��Na2CO3�Ĵ��ڣ���Ҫ�ų�SO2����ĸ��ţ����岽�����ȼ�������ϡ���ᣬ��Ӧ����SO2��CO2���壬Ȼ�������Ը��������Һȥ��SO2����Ʒ����Һ���SO2�Ƿ���������ó���ʯ��ˮ����CO2�Ĵ��ڡ������� ȡC����Һ�������μ�����E���� ������������������ͨ��B��A��D��ʵ������ͽ���ΪKMnO4��Һ��ɫ��dz��Ʒ����Һ����ɫ������ʯ��ˮ����ǣ���C��Һ�к���Na2CO3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij�ֹ��ԣ��ɽ�CO2��SO2��Ϊһ����������������У�Ҳ����ͬ����������ǣ�������
A.CaCO3
B.SO3
C.CuO
D.KMnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1 mol/LNaOH��0.1 mol/LNH4Cl��Һ�������Ϻ�������Ũ�ȴ�С����ȷ˳����
A��c(Na+)>c(Cl��)>c(OH��)>c(H+) B��c(Na+)=c(Cl��)>c(OH��)>c(H+)
C��c(Na+)=c(Cl��)>c(H+)>c(OH��) D��c(Cl��)>c(Na+)>c(OH��)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ������ҵ��ɰ�ǡ���֬��Ư����ɱ�������У�����������NaClO2����������Ҫ�����á���ͼ�������������ƵĹ�������ͼ��
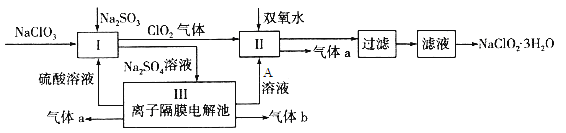
��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ����NaClO2��3H2O��
�������£�Ksp��FeS��=6.3��10-18��Ksp��CuS��=6.3��10-36��Ksp��PbS��=8��10-28
�ۢ�װ���е����������Һ����������������ͬʱ�������ᣬ��������������ͬʱ�����������ơ�
��1�� I�з�����Ӧ�����ӷ���ʽΪ ____________��
��2������Һ�еõ�NaClO2��3H2O������������������ ����д�������
a������ b������Ũ�� c������ d����ȴ�ᾧ e������
��3��ӡȾ��ҵ��������������NaClO2��Ư��֯�Ư��֯��ʱ���������õ���HClO2���±���25��ʱHClO2�����ֳ�������ĵ���ƽ�ⳣ����
���� | HClO2 | HF | H2CO3 | H2S |
Ka��mol��L-1 | 1��10-2 | 6.3��10-4 | K1=4.30��10-7 K2=5.60��10-11 | K1=9.1��10-8 K2=l.1��10-12 |
�������£����ʵ���Ũ����ȵ�NaClO2��NaF��NaHCO3��Na2S������Һ��pH�ɴ�С��˳��Ϊ ���û�ѧʽ��ʾ����
��Na2S�dz��õij�������ij��ҵ��ˮ�к��е�Ũ�ȵ�Cu2+��Fe2+��Pb2+���ӣ��μ�Na2S��Һ�����������ij����� �������£������һ�����ӳ�����ȫʱ��������Ũ��Ϊ10-5mol��L-1����ʱ��ϵ�е�S2-��Ũ��Ϊ ��
��4����װ��������������a�����Ϊ1.12L����״��������ת�Ƶ��ӵ����ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ����������һ����ȷ���ǣ� ��
A. �����£�0.1mol/L��NH4NO3��Һ�е�ԭ����Ϊ0.2 NA
B. 1 mol�ǻ��еĵ�����Ϊ10 NA
C. �����£�1mol SiC�к���Si��C������ĿΪ4 NA
D. 28g����������Cl2��Ӧʱת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ������ڵ�һ���֣�Zԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1�����������������

A. X��Z�⻯������ȶ��Ժͻ�ԭ�Ծ����μ���
B. R��W��������Ԫ���γɵ���������2������
C. RY2������ÿ��ԭ�ӵ�������Ϊ8���ӽṹ
D. R��Y��Z������������Ӧ��ˮ���������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС��Ե������Һ�����µĹ����ܽᣨ���ڳ����£�����֪����ƽ�ⳣ����CH3COOH��H2CO3��C6H5OH ��HCO![]() �����в���ȷ����
�����в���ȷ����
A��pH��ȵ�������Һ��a��CH3COONab��C6H5ONac��NaHCO3d��NaOH����������Һ�����ʵ����ʵ���Ũ����С����˳��Ϊ��d<b<c<a
B��pH=8.3��NaHCO3��Һ��c(Na��)��c(HCO3��)��c(CO32��)��c(H2CO3)
C��pH��2��һԪ����pH��12�Ķ�Ԫǿ��������ϣ�c(OH��)��c(H��)
D��pH��4Ũ�Ⱦ�Ϊ0.1mol��L��1��CH3COOH��CH3COONa�����Һ�У�c(CH3COO��)��c(OH��)��c(CH3COOH)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����ܰ�ͼʾ����������ʾһ����ɣ���ϵ�ת������
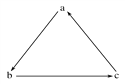
ѡ�� | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | H2SO4 | SO2 | SO3 |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɱ���ܱ������У�����һ������X��Y��Z�������� ӦmX��g�� ![]() nY��g��+pZ��s�� ��H = Q kJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ�����ʾ��
nY��g��+pZ��s�� ��H = Q kJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ�����ʾ��
����˵����ȷ������ ��
�������/L c��Y��/molL-1 �¶�/�� | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
A��m>n+p
B��Q<0
C���¶Ȳ��䣬ѹǿ����Y�������������
D��������䣬�¶����ߣ�ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com