
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
| ||
 ,
, ;
; ;②的单质是N2,电子式为
;②的单质是N2,电子式为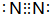 ,
, ;
; ,
, ;
;
| ||
| ||
| ||


科目:高中化学 来源: 题型:
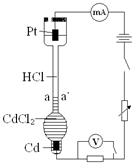 设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )
设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )| A、通电时,H+、Cd2+向Cd电极迁移,Cl-向Pt电极迁移 | ||||
| B、一定时间内,如果通过HCl溶液某一界面的总电量为1.0 C,测得H+所迁移的电量为0.82 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 | ||||
| C、如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 | ||||
D、装置中总反应的化学方程式为:2HCl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的NaHCO3溶液中离子浓度的关系:c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
| B、0.1mol/L的NH4Cl溶液和0.1mol/L的NH3?H2O等体积混合后离子浓度的关系:c(NH4+)>c( Cl-)>c(OH-)>c(H+) |
| C、常温下,物质的量浓度相等的醋酸溶液与氢氧化钠溶液等体积混合,所得溶液PH=7 |
| D、KHS溶液中存在等式关系:c(S2-)+c(OH-)=c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g | B、20g |
| C、22g | D、24g |
查看答案和解析>>
科目:高中化学 来源: 题型:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G | I | J | ||
| 4 | K |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应生成了1.5mol的水蒸气 |
| B、用O2表示该反应速率为2.5mol/(L?min) |
| C、反应后容器中NO的浓度为0.5mol/L |
| D、反应后容器中n(NH3)=n(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、140mL | B、120mL |
| C、100mL | D、80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2=CH2、C2H5OH、HOCH2CH2COOH |
| B、CH2O、C2H4O2、C6H12O6 |
| C、C6H6、C5H10、C6H6O |
| D、H2、CO、CH3OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com