

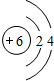 ;碳元素与原予半径最小的原子形成10电子且为正四面体结构的化合物为CH4,分子中C原子与H原子之间形成1对共用电子对,其电子式为:
;碳元素与原予半径最小的原子形成10电子且为正四面体结构的化合物为CH4,分子中C原子与H原子之间形成1对共用电子对,其电子式为: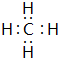 ;⑤和⑧形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程为:
;⑤和⑧形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程为: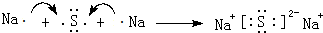 ,
,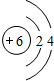 ;
;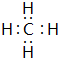 ;
;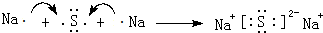 ;
;

科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 胆矾 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 石灰石 | 水 |
| D | 苛性钠 | 碳酸 | 碳酸镁 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ,该离子的符号为
,该离子的符号为查看答案和解析>>
科目:高中化学 来源: 题型:
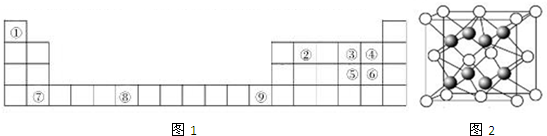
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上通过设法除去乙醇和氢氧化钠的作用生成的水来制取乙醇钠 |
| B、只使用试管和胶头滴管即可鉴别NaNO2、NaCl、AgNO3、H2SO4四种无色溶液 |
| C、将燃烧的镁条伸入混合气体,以除去CO2中的N2 |
| D、用硫酸镁和硫酸亚铁混合溶液制摩尔盐的过程:蒸发浓缩→冷却结晶→抽滤→用水洗涤2-3次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com