
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ,该化合物中只含离子键,所以属于离子化合物,故答案为:
,该化合物中只含离子键,所以属于离子化合物,故答案为: ;离子;
;离子;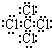 ,C原子和Cl原子之间形成极性键,故答案为:
,C原子和Cl原子之间形成极性键,故答案为: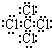 ;极性;
;极性;
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)铝可将水中的NO3-转化为N2,从而消除污染.该反应中涉及的粒子有:H2O、Al、AlO2-、Al(OH)3、NO3-、N2,请将这些粒子中除NO3-以外的粒子填入以下空格内(要配平)
(1)铝可将水中的NO3-转化为N2,从而消除污染.该反应中涉及的粒子有:H2O、Al、AlO2-、Al(OH)3、NO3-、N2,请将这些粒子中除NO3-以外的粒子填入以下空格内(要配平)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 NaHCO3溶液中:c(H+)+2c(H2CO3)=2c(CO32-)+c(OH-) |
| B、0.1mol?L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| C、将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) |
| D、pH相等的①CH3COONa ②C6H5ONa ③Na2CO3 ④NaOH四种溶液的物质的量浓度大小:①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汤姆生、卢瑟福、威尔等科学家对原子结构模型的提出作出了很大贡献 |
B、海水提取单质镁的主要步骤为: |
| C、酸碱盐各物质的组成中一定都含有非金属元素 |
| D、严格地讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com