
【题目】下列说法不正确的是( )
A.硫酸铜是常用的游泳池水消毒剂,也可用于饮用水的消毒
B.氯化铁溶液与铜反应可用于制作印刷电路板
C.利用高纯硅可以制成光电池,将光能直接转化为电能
D.纯碱是一种重要的化工原料,广泛应用于玻璃、肥皂、造纸、食品等工业
科目:高中化学 来源: 题型:
【题目】我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是
A. 反应进行的方向 B. 反应的快慢 C. 反应进行的限度 D. 反应物的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是
分类组合 | 纯净物 | 碱 | 盐 | 碱性氧化物 |
A | 碱石灰 | 氢氧化钡 | 苏打 | 氧化铝 |
B | H2O2 | 纯碱 | 小苏打 | 氧化镁 |
C | 水煤气 | NH3·H2O | 苛性钠 | 氧化钙 |
D | 五水硫酸铜 | 氢氧化钠 | 碱式碳酸铜 | 氧化钠 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偶氮苯是橙红色晶体,溶于乙醇,微溶于水,实验室制取反式偶氮苯的步骤如下:
步骤一:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤二:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH 为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤三:用95%的乙醇重结晶。
(1)步骤一中反应不需要加热就能剧烈进行,原因是____________。镁粉分两次加入的原因是______________。
(2)步骤二中析出固体用冰水洗涤的原因是______________。若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管和锥形瓶外还应有___________。
(3)取0.1g偶氦苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1cm处,再将滤纸条末端浸入裝有1: 3 的苯-环己烷溶液的容器中,实验操作及现象如图所示。
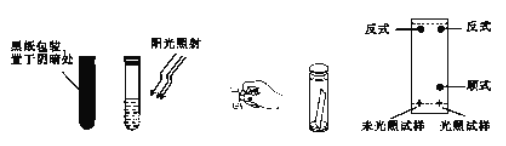
①实验中分离物质所采用的方法是_______法。
②由实验结果可知:_______;利用该方法可以提纯反式偶氮苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是
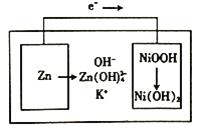
A. 放电时溶液中的K+移向负极
B. 充电时阴极附近的pH会升高
C. 放电时正极反应为H++NiOOH+e-=Ni(OH)2
D. 负极质量每减少6.5g,溶液质量增加6.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
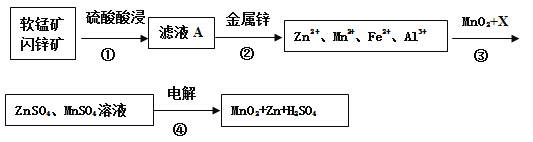
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________。
(3)步骤③中MnO2的其作用是__________________,另外一种物质X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)⑦的最低负价是;⑧的最高价含氧酸的化学式为 .
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为 .
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 .
(4)⑤、⑥的单质中更容易与①的单质反应的是 .
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式 .
(6)用电子式表示③和⑨组成的化合物的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要除去氯化钠溶液中含有的少量碳酸钠,可采用的方法是( )
A.通入适量的CO2B.加入过量的BaCl2溶液
C.加入适量的稀盐酸D.加入过量的稀硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com