
| A、K越大,达到平衡时,反应进行的程度越大 |
| B、K越小,达到平衡时,反应物的转化率越大 |
| C、K随反应物浓度的改变而改变 |
| D、K随着温度的升高而增大 |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、C6H5CH2OH 酚类-OH |
| B、CH3CH2COOH 羧酸-COOH |
| C、HCOOCH3 醛类-CHO |
| D、H3CCH2CH3 烃类-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25% | B、40% |
| C、35% | D、80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | F-D | F-F | B-B | F-B | C═D | D═D |
| 键能/kJ?mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2+2H2O+4e-=4OH- |
| B、2H++2e=H2↑ |
| C、4 OH-=2H2O+O2+4e- |
| D、Fe=Fe2++2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH2(COOC2H5)2 |
| C2H5OH |
| ①OH-,②H3O+ |
| ③△ |
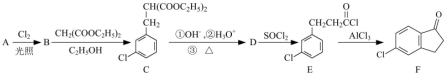
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com