
【题目】乙醛是一种重要的烃类衍生物,广泛应用于纺织、医药、化纤、染料和食品工业。
(一)以乙烯和氧气(或空气)为原料,在由PdCl2、CuCl2、盐酸组成的催化剂水溶液中,进行液相氧化生产乙醛,工业上一般控制反应温度在120~130℃,压强在300~350KPa。又称Wacker法。其反应式为:
主反应:CH2═CH2(g) +![]() O2(g)
O2(g) ![]() CH3CHO(g) ΔH=-243.2 kJ·mol-1
CH3CHO(g) ΔH=-243.2 kJ·mol-1
副反应:![]() CH2═CH2(g) +
CH2═CH2(g) + ![]() O2(g)
O2(g) ![]() CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1
CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1
(1)已知:水的汽化热是44.0 kJ·mol-1,请计算乙烯的燃烧热:ΔH =__________ kJ·mol-1
汽化热:在标准大气压(101KPa)下,使1mol物质在一定温度下蒸发所需要的热量。
(2)Wacker法乙烯氧化制乙醛过程,按照以下机理进行:
①乙烯羰基化反应:_____________________________
②金属钯的再氧化反应:Pd + 2CuCl2 = PdCl2 + 2CuCl
③氯化亚铜的氧化反应:2CuCl + ![]() O2 + 2HCl = 2CuCl2 + H2O
O2 + 2HCl = 2CuCl2 + H2O
请写出①的反应方程式__________________________。
(3)下列有关说法正确的是_______________
A.Wacker法制乙醛反应中,氯化钯是反应催化剂,氯化铜的作用是使催化剂再生,没有氯化铜的存在,就不能完成此催化过程。
B.工业上采用的原料气中乙烯大量过量,并有大量未反应的乙烯气要循环使用,这样可提高乙烯利用率,同时原料气中加入CO2有利于提高乙醛选择性。
C.原料气中乙烯大量过量的原因可能是为了让乙烯的体积分数处在爆炸极限范围之外,以避免危险的发生。
D.乙烯氧化生成乙醛的反应是在气-液相中进行的,加压和升温都有利于提高乙烯和氧在液体中的溶解度,加快反应速率。
(4)控制反应条件在120~130℃和300~350KPa,原料气的体积比是V(C2H4):V(O2):V(CO2):V(N2) = 15:10.5:9.5:65,以一定流速通入催化剂水溶液中,一段时间后反应达平衡,测得乙烯的体积分数是0.1,氧气的体积分数是0.05,如果充入100mol原料气,请计算反应达平衡时,n(CH3CHO) =
___________ mol。(不考虑HCl的挥发)
(二)实际工业生产要求有较高产量,速率不能太低,转化率尽可能大,所以应尽量使平衡正向移动。
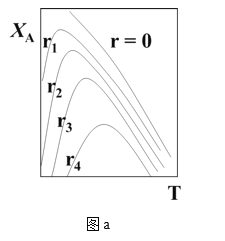
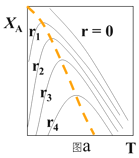
(1)可逆反应:aA+bB![]() rR +s S ,对反应物A,净反应速率为rA = r正(XA) – r逆(XA),XA为反应物A的转化率,图a表示反应物A的转化率和A的净反应速率与温度(T)的关系图。图a分析可知,在相同温度下,净反应速率为________时,XA最大(从“r=0、r1、r2、r3、r4”选填);由图a判断该反应是__________反应(填“吸热”或“放热”),并简述原因__________。
rR +s S ,对反应物A,净反应速率为rA = r正(XA) – r逆(XA),XA为反应物A的转化率,图a表示反应物A的转化率和A的净反应速率与温度(T)的关系图。图a分析可知,在相同温度下,净反应速率为________时,XA最大(从“r=0、r1、r2、r3、r4”选填);由图a判断该反应是__________反应(填“吸热”或“放热”),并简述原因__________。
(2)请在图a中绘制:在不同r下,符合工业生产要求的最佳温度__________。
【答案】-1499 CH2═CH2(g) + PdCl2 + H2O = CH3CHO + Pd + 2HCl ABC 4 r=0 放热 由图分析可知,反应达平衡时(r=0),随温度升高,XA降低,故该反应为放热反应 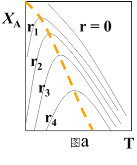
【解析】
利用已知热化学反应计算待求反应的H时,首先根据待求反应的反应物与生成物,选择相关的热化学反应,然后调整化学计量数进行相加减;在书写乙烯羰基化反应方程式时,需要考虑催化剂参与反应,所以方程式中应出现催化剂及中间产物;在判断说法的正误时,应从工业生产的实际出发,借助化学反应方程式进行判断;在计算乙醛的产量时,首先应分析发生的反应,然后建立三段式,利用已知数据建立关系式;在对坐标图象进行分析时,首先要弄清横坐标与纵坐标表示的意义,其次分析曲线的走势,从而确定曲线中特殊点产生的原因。
(一) (1)![]() CH2═CH2(g) +
CH2═CH2(g) +![]() O2(g)
O2(g) ![]() CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1 ①
CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1 ①
H2O(g) ![]() H2O(l) ΔH=-44.0kJ·mol-1 ②
H2O(l) ΔH=-44.0kJ·mol-1 ②
利用盖斯定律,将①×2+②×2可得乙烯的燃烧热:ΔH =[(-705.5)×2+(-44.0)×2] kJ·mol-1=-1499 kJ·mol-1。答案为:-1499;
(2)乙烯羰基化是指乙烯在PdCl2的氧化下生成CH3CHO、Pd 等,则①的反应方程式为:CH2═CH2(g) + PdCl2 + H2O = CH3CHO + Pd + 2HCl。答案为:CH2═CH2(g) + PdCl2 + H2O = CH3CHO + Pd + 2HCl;
(3)A.Wacker法制乙醛反应中,氯化钯是反应的催化剂,参与反应(将乙烯氧化为乙醛)后被还原为Pd,CuCl2将其氧化为PdCl2,又可表现出催化能力,从而完成催化过程,A正确;
B.工业上采用的原料气中乙烯大量过量,可促进平衡正向移动,提高乙醛的产量,虽然乙烯的转化率降低,但由于原料气的循环使用,最终可提高乙烯的利用率;原料气中加入CO2,可降低乙烯氧化生成CO2的转化率,有利于提高乙醛的选择性,B正确;
C.乙烯与O2混合达到一定体积分数范围时会发生爆炸,所以原料气中乙烯大量过量的原因可能是为了让乙烯的体积分数处在爆炸极限范围之外,C正确;
D.乙烯氧化生成乙醛的反应是在气-液相中进行的,加压有利于提高乙烯和氧在液体中的溶解度,加快反应速率,但升温对乙烯和氧在液体中的溶解不利,D不正确;
故选ABC。答案为:ABC;
(4)原料气的体积比是V(C2H4):V(O2):V(CO2):V(N2) = 15:10.5:9.5:65,充入100mol原料气,则n(C2H4) =100mol×15%=15mol,n(O2) =100mol×10.5%=10.5mol。
设生成CH3CHO的CH2=CH2物质的量为x,燃烧生成CO2的CH2=CH2物质的量为y,则可建立下列三段式:
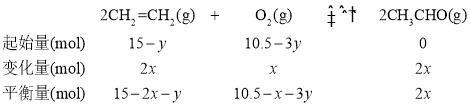
则![]() ①
①
![]() ②
②
解①、②方程,可求出x=2mol,所以反应达平衡时,n(CH3CHO) =4 mol。答案为:4;
(二)(1)图a分析可知,在相同温度下,转化率最大的点,其净反应速率为0,所以净反应速率为r=0时,XA最大;由图a可知,当转化率达到最高点后,升高温度,反应物的转化率降低,则平衡逆向移动,所以该反应是放热反应,原因是:由图分析可知,反应达平衡时(r=0),随温度升高,XA降低,故该反应为放热反应。答案为:r=0;放热;由图分析可知,反应达平衡时(r=0),随温度升高,XA降低,故该反应为放热反应;
(2)在不同r下,符合工业生产要求的最佳温度,是r=0的各个点的连线,图象为:
 。答为:
。答为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于阿伏伽德罗常数(NA)说法正确的是( )
A.lLpH=l的H3PO4溶液中,含有0.1NA个H+
B.在6.0gNaHSO4晶体中,所含离子数目为0.15NA
C.加热条件下,1molFe投入足量的浓硫酸中,生成NA个SO2分子
D.8.4g环戊烯醇![]() ,含有0.8NA个极性键
,含有0.8NA个极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.将0.1 mol·L-1 CH3COOH溶液从20 ℃升温至30 ℃,溶液中c(H+)/c(CH3COOH)减小
B.若NH4Cl溶液与NH4HSO4溶液的pH相等,则c(NH![]() )也相等
)也相等
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层中臭氧分解过程如图所示,下列说法正确的是
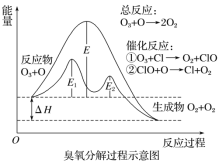
A.催化反应①②均为放热反应
B.E1是催化反应①对应的正反应的活化能,(E2+ΔH)是催化反应②对应的逆反应的活化能。
C.决定O3分解反应速率的是催化反应②。
D.温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以浓缩海水(含较高浓度的Br-)为原料提取溴的部分流程如下:
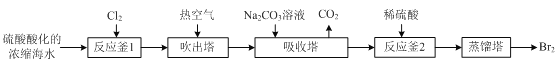
已知:3Br2+3CO32- =5Br- +BrO3- +3CO2↑。
图甲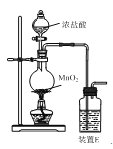 图乙
图乙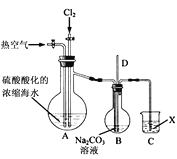
(1)反应用的Cl2可由图甲所示装置制取,制取Cl2的化学方程式为____。为除去Cl2中挥发出的HCl,装置E中所盛溶液是____。
(2)实验室用图乙所示装置模拟流程中的部分过程。
①通入Cl2时发生反应的离子方程式为____。
②通入热空气的作用是____。
③烧杯C中所盛溶液是____。
④烧瓶B中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,可以观察到的现象是____。
(3)“反应釜2”中所发生反应的离子方程式为____。
(4)蒸馏后,蒸馏塔溶液中仍溶有少量Br2,可以向其中加入少量____萃取其中的Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下3.6gH2O含有的电子数为2NA
B.2.8g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C.0.lmolCl2与足量的铁粉充分反应转移的电子数为0.2NA
D.1L0.2mol/l的K2SO3溶液中SO![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2(g)+2I2(g)![]() TaI4(g)+S2(g)
TaI4(g)+S2(g)

下列说法正确的是 ( )
A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2的作用是将TaS2 从高温区转移到低温区
D.该正反应的平衡常数与TaI4 和S2 的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向某溶液中滴加少量AgNO3溶液,有白色沉淀产生,溶液中一定含有Cl-
B.向某溶液中加入一定量的稀硫酸,产生的气体使澄清石灰水变浑浊,溶液中一定含有SO32-或CO32-
C.将灼热的木炭与浓硝酸反应产生的气体缓缓通入澄清石灰水中,溶液没有沉淀产生
D.向某溶液中滴加少量浓NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明该溶液中一定不含NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com