
【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是元素周期表中6种元素的相关信息,其中Q、W、X位于同一周期。
元素 | 信息 |
Q | 单质是稳定的半导体材料,用于制造芯片 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色反应为紫色(透过蓝色钴玻璃片) |
Z | 地壳中含量最高的金属元素,其合金可用于制造飞机外壳 |
M | 原子结构示意图为 |
(1)Q元素所在周期表的位置为_____。
(2)W单质的电子式为_____。
(3)Z的单质与X的最高价氧化物对应的水化物反应的离子方程式为_____。
(4)Y的金属性强于X,请结合原子结构解释其原因_____。
(5)下列对于M及其化合物的推断中,正确的是_____(填序号)。
①M的最低负化合价与W的最低负化合价相同
②M的氢化物的稳定性弱于W的氢化物的稳定性
③M的单质可与X和W形成的化合物的水溶液发生置换反应
(6)与M位于同一主族,电子层数比M多一层的元素在生活中的用途是_____(写出一条即可)。
【答案】第三周期,第ⅣA 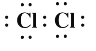 2Al+2OH-+2H2O=2AlO2-+3H2↑ 钠和钾位于同一主族,同主族元素从上到下半径逐渐增大,原子核对核外电子的吸引能力减弱,失电子能力逐渐增强,金属性增强 ①② 制加碘食盐
2Al+2OH-+2H2O=2AlO2-+3H2↑ 钠和钾位于同一主族,同主族元素从上到下半径逐渐增大,原子核对核外电子的吸引能力减弱,失电子能力逐渐增强,金属性增强 ①② 制加碘食盐
【解析】
Q单质是稳定的半导体材料,用于制造芯片,则Q为Si元素;Q、W、X都位于第三周期,W的最高正化合价为+7价,则W为Cl;X的最高价氧化物对应的水化物在本周期中碱性最强,X为Na;Y焰色试验(透过蓝色钴玻璃)火焰呈紫色,则Y为K;Z是地壳中含量最高的金属元素,其合金可用于制造飞机外壳,为Al,M的原子结构示意图为 ,是Br,Q、W、X、Y、Z、M分别是Si、Cl、Na、K、Al、Br,以此来解答。
,是Br,Q、W、X、Y、Z、M分别是Si、Cl、Na、K、Al、Br,以此来解答。
(1)Q元素是Si元素,有三个电子层,最外层电子数为4,所在周期表的位置为是第三周期第ⅣA;
(2)氯气分子中氯原子形成一对共用电子对,W单质的电子式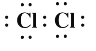 ;
;
(3)Z是铝,它的单质与X的最高价氧化物对应的水化物(氢氧化钠)反应为铝和氢氧化钠溶液的反应,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑:离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)Y(K)的金属性强于X(Na),钠和钾位于同一主族,同主族元素从上到下半径逐渐增大,原子核对核外电子的吸引能力减弱,失电子能力逐渐增强,金属性增强,金属性钾大于钠;
(5)①M(Br)的最低负化合价为-1价,W(Cl)的最低负化合价为-1价,故①正确;
②溴的非金属性弱于氯,M(Br)的氢化物的稳定性弱于W(Cl)的氢化物的稳定性,故②正确;
③溴的非金属性弱于氯,单质的氧化性溴弱于氯气,溴不能与氯化钠的水溶液发生置换反应,故③错误;
正确的是①②;
(6)与M(Br)位于同一主族,电子层数比M多一层的元素是碘,在生活中的用途是制加碘食盐。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CaCO3溶于CH3COOH溶液中,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
B.向AlCl3溶液中通入过量NH3,反应的离子方程式为:Al3++4OH-=![]() +2H2O
+2H2O
C.下列四种离子因发生氧化还原反应而不能大量共存:K+、Fe3+、SCN-、Cl-
D.向稀硫酸中滴入Ba(OH)2溶液,反应的离子方程式为:Ba2++2OH-+2H++![]() =2H2O+BaSO4↓
=2H2O+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:6H2(g)+2CO2(g)![]() C2H5OH(g)+3H2O(g)的数据如图所示。
C2H5OH(g)+3H2O(g)的数据如图所示。
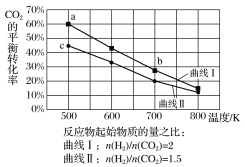
下列说法正确的是( )
A.该反应为吸热反应
B.达平衡时,v正(H2)=v逆(CO2)
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
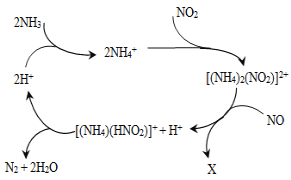
A.X是N2
B.NH![]() 中含有非极性共价键
中含有非极性共价键
C.NH3、NH![]() 、H2O中的质子数、电子数均相同
、H2O中的质子数、电子数均相同
D.上述历程的总反应为:2NH3+NO+NO2![]() 2N2+3H2O
2N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )
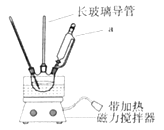
A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接乙醇燃料电池(DEFC) 具有无毒、来源丰富等优点,其装置如下图所示。装置工作时,下列说法错误的是
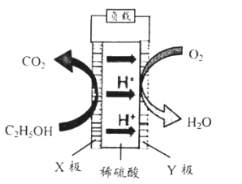
A.化学能转化为电能B.稀硫酸为该电池的电解质溶液
C.电子由Y极流出经负载流向X极D.电池反应为C2H5OH+ 3O2→2CO2+ 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)![]() CH3OH(l)+
CH3OH(l)+![]() O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l)![]() CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__,反应进行程度最大的是__。
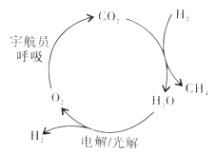
(2)反应CO2+4H2![]() CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__(填化学式)。
②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 868 | 90.1 |
Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:__(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__(填“增大”或“减小”),其可能的原因是__。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__(列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__。(已知Co的性质与Fe相似)
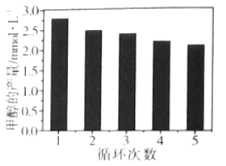
查看答案和解析>>
科目:高中化学 来源: 题型:
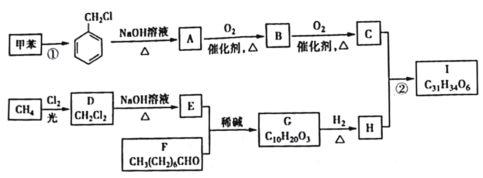
【题目】有机物I是一种治疗高血脂病的新药,其合成路线如下:
已知:a. 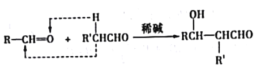 b.
b. 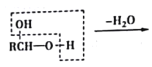 RCHO
RCHO
回答下列问题。
(1)①的反应类型是______________;A的名称是______________。
(2)C中官能团的名称为______________;②的反应条件为______________。
(3)H的结构简式为______________。
(4)写出D→E的化学方程式:______________。
(5)化合物W的相对分子质量比C的大28 ,写出满足下列条件的所有W的结构简式:______________。
①属于芳香族化合物②遇FeCl3溶液能发生显色反应,能发生银镜反应③其核磁共振氢谱有4种不同化学环境的氢,峰面积之比为6:2:1:1
(6)结合题目信息,设计用甲苯和丙醛为原料制备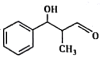 的合成路线_______________。(其他无机原料自选,合成路线用A
的合成路线_______________。(其他无机原料自选,合成路线用A![]() B…
B…![]() 目标产物来表示)
目标产物来表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com