
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如右图所示。下列说法正确的是

A.铁是阳极,电极反应为Fe-2e-+2OH-![]() Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
科目:高中化学 来源: 题型:
【题目】某课外活动小组为探究金属与浓硫酸反应,进行了如下实验。
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示。(固定装置已略去)
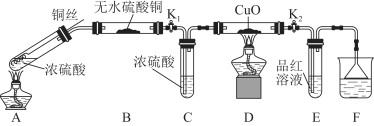
(1)A中反应的化学方程式为 ;
A装置铜丝如图设计的原因是 。
(2)C中浓硫酸的作用是 。
(3)F烧杯中的溶液通常是 。
(4)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是 。
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质按照强电解质、弱电解质、非电解质、能导电的顺序排列的选项是
A. 氯化氢 氨气 甲烷 铜
B. H2SO4 HF 乙醇 氯化钠溶液
C. 氢氧化钡 氢氧化钙 二氧化碳 氨水
D. 氯化氢 食醋 葡萄糖 银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明氧的非金属性比硫强的事实是( )
A. H2O的热稳定性强于H2S
B. 硫化氢水溶液露置于空气中变浑浊
C. H2O是液体,H2S常温下是气体
D. 氧气和氢气化合比硫和氢气化合容易
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届济南一模】高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂,下图是在实验室中制备KMnO4晶体的流程:
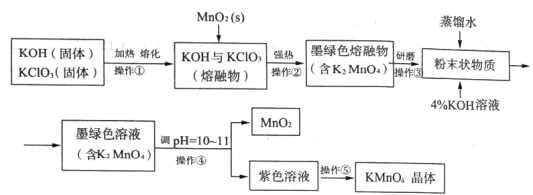
回答下列问题:
(1)操作②目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式: _______________。操作①和②均需在坩埚中进行,根据实验实际应选择_______________(填序号)。
a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚
(2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为_______________。若溶液碱性过强,则MnO4-又会转化为MnO42-,该转化过程中发生反应的离子方程式为_______________。因此需要通入某种气体调pH=10-11,在实际操作中一般选择CO2而不是HCl,原因是_______________。
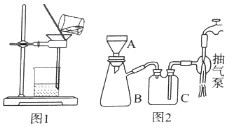
(3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是_______________。
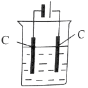
(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为_______________。溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 白色污染是指橡胶造成的污染
B. 硫和氮的氧化物是形成酸雨的主要物质
C. 汽车尾气的排放是造成温室效应的罪魁祸首
D. 含磷洗涤剂的使用是造成水体富营养化的唯一原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将22.4 L HCl溶于水配制1 L溶液,其溶质的物质的量浓度为1.0 mol/L
B.1 mol/L的Na2CO3溶液中含有2 mol Na+
C.500 mL 0.5 mol/L的(NH4)2SO4溶液中含有NH4+个数为0.5NA(NA为阿伏加德罗常数)
D.Na+浓度为0.2 mol/L的Na2SO4溶液中SO42-浓度为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
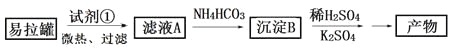
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com