
【题目】以下物质按照强电解质、弱电解质、非电解质、能导电的顺序排列的选项是
A. 氯化氢 氨气 甲烷 铜
B. H2SO4 HF 乙醇 氯化钠溶液
C. 氢氧化钡 氢氧化钙 二氧化碳 氨水
D. 氯化氢 食醋 葡萄糖 银
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 molL-1,
2C(g)。若经2s后测得C的浓度为0.6 molL-1,
求(1)A表示的反应的平均速率?
(2)2 s时物质B的浓度?
(3)2 s时物质A的转化率?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活息息相关。下列说法不正确的是
A.玻璃、水晶和陶瓷都是传统硅酸盐材料
B.可溶性铝盐和铁盐可用作净水剂
C.SO2和NO都能形成酸雨而破坏环境
D.CO2和CH4都是引起温室效应的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=;反应II的ΔH2=kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A. 上述反应在较高温度下才能自发进行
B. 该反应的正反应活化能小于逆反应活化能
C. 该反应中,断裂化学键的总键能大于形成化学键的总键能
D. 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁合金与铁的物理性质的比较如下表所示:
熔点(℃) | 密度(g /cm3) | 硬度(金刚石为10) | 导电性(银为100) | |
某铁合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该铁合金耐腐蚀,强度大。从以上性能看,该铁合金不适合用作( )
A.导线 B.门窗框 C.炉具 D.飞机外壳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
(1) X、Y、Z的第一电离能从大到小的顺序是___________(用元素符号表示,下同)。
(2)写出W的价电子排布式_____________,W同周期的元素中,与W原子最外层电子数相等的元素还有____________。
(3)根据等电子体原理,可知化合物XZ的结构式是__________, YZ2-的VSEPR模型是___________。
(4) X、Y、Z的.简单氮化物的键角从大到小的顺序是_______(用化学式表示),原因是________________
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式___________,该物质硬度大,推测该物质为_________晶体。其中Y元素的杂化方式是______。
(6)U的晶体属立方晶系,其晶胞边长为405pm ,密度是2.70g/cm3,通过计算确定其晶胞的类型_____(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
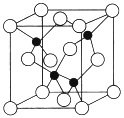
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如右图所示。下列说法正确的是

A.铁是阳极,电极反应为Fe-2e-+2OH-![]() Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com