
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 molL-1,
2C(g)。若经2s后测得C的浓度为0.6 molL-1,
求(1)A表示的反应的平均速率?
(2)2 s时物质B的浓度?
(3)2 s时物质A的转化率?
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景.
(1)如图是从海水中提取镁的简单流程.
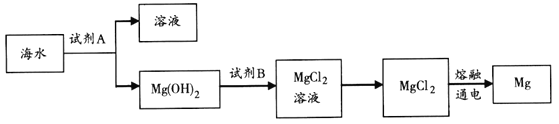
①工业上常用于沉淀Mg2+的试剂A是________,Mg(OH)2转化为MgCl2的离子方程式是_______.
②由无水MgCl2制取Mg的化学方程式是________.
(2)海带灰中富含以I﹣形式存在的碘元素.实验室提取I2的途径如下所示:
![]()
①灼烧海带至灰烬时所用的主要仪器名称是________.
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________.
③反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图:
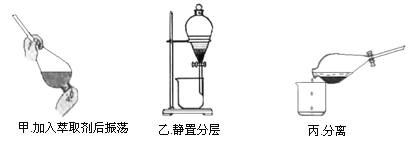
甲、乙、丙3步实验操作中,不正确的是________(填“甲”、“乙”或“丙”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据右图铜锌原电池示意图,回答下列问题:
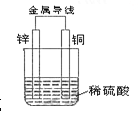
(1)该原电池总离子反应式是 。
(2)外电路电流的方向是从 (填Zn到Cu或Cu到Zn)。
(3)在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量 (填“增加”、“不变”或“减少”),电路中转移电子为 mol,铜表面析出了氢气 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C10H20O2)具有兰花香味,可用做香皂、洗发香波的芳香赋予剂。

已知:①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯原子取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)。
a、取代反应 b、消去反应 c、加聚反应 d、氧化反应
(2)C、D、F分子所含的官能团的名称依次是
(3)写出E的结构简式:
(4)写出C→D的化学方程式:
(5)写出B→F的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置反映了元素的原子结构和元素的性质。下是元素周期表的一部分。
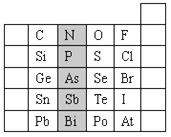
(1)阴影部分元素N在元素周期表中的位置为 。
根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Zn—Cu—硫酸溶液组成的原电池,工作一段时间后,锌片的质量减少了6.5 g。回答下列问题:
(1)上述原电池的正极是:___________,负极的电极反应式:__________________________________。
(2)若将电解质溶液改为硫酸铜溶液,负极是:________,正极的电极反应式:_________________。当电池输出相同的电量时,电池两极的质量差为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为探究金属与浓硫酸反应,进行了如下实验。
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示。(固定装置已略去)
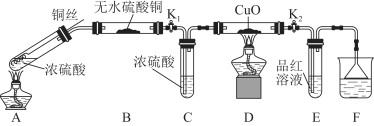
(1)A中反应的化学方程式为 ;
A装置铜丝如图设计的原因是 。
(2)C中浓硫酸的作用是 。
(3)F烧杯中的溶液通常是 。
(4)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是 。
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质按照强电解质、弱电解质、非电解质、能导电的顺序排列的选项是
A. 氯化氢 氨气 甲烷 铜
B. H2SO4 HF 乙醇 氯化钠溶液
C. 氢氧化钡 氢氧化钙 二氧化碳 氨水
D. 氯化氢 食醋 葡萄糖 银
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com