
【题目】由Zn—Cu—硫酸溶液组成的原电池,工作一段时间后,锌片的质量减少了6.5 g。回答下列问题:
(1)上述原电池的正极是:___________,负极的电极反应式:__________________________________。
(2)若将电解质溶液改为硫酸铜溶液,负极是:________,正极的电极反应式:_________________。当电池输出相同的电量时,电池两极的质量差为______________。
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s)。2 min 时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
xC(g)+2D(s)。2 min 时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,A的转化率为________。
(2)x=________。
(3)下列各项可作为该反应达到平衡状态的标志的是________(填各项代号)
A.压强不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.A的消耗速率与B的消耗速率之比为2:1
Ⅱ.一定条件下,可逆反应A2(g)+B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.4mol·L—1;c(B2)=0.1mol·L—1;c(C)=1.6mol·L—1。
2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.4mol·L—1;c(B2)=0.1mol·L—1;c(C)=1.6mol·L—1。
(1)若反应开始时,反应容器中未加入B,10s后达到平衡,则10s内用C的浓度变化表示的化学反应速率为_____________。
(2)若A2、B2、C的初始浓度分别用a、b、c表示(mol·L—1),则:a、b应满足的关系是 。a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 molL-1,
2C(g)。若经2s后测得C的浓度为0.6 molL-1,
求(1)A表示的反应的平均速率?
(2)2 s时物质B的浓度?
(3)2 s时物质A的转化率?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题有三小题。
(1)已知N2,CO,H2O,NH3,CO2均为高中化学常见的分子,根据要求回答有关问题:
①根据等电子体原理,写出CO分子的结构式___________。
②试比较两分子中的键角大小:H2O___________NH3,(填“>”、“=”或“<” )
③基态N原子核外电子有 种不同的运动状态, B、C、N、O的第一电离能由大到小的顺序为 .
(2)科学家合成了Si60、N60, Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则28 g Si60分子中π键的数目为 。
(3)①立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________ 。
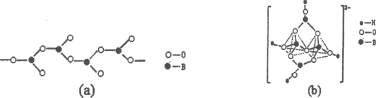
②在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。
(4) “嫦娥五号”探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质,回答下列问题:
①SeO3分子的立体构型为 .
②金属铜投入氨水或H2O2溶液中均无明显现象,但投入氨水与H2O2的混合溶液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子反应方程式为 .
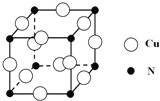
③某种铜合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子间的距离为![]() pm,则该晶体的密度为 (用含a的代数式表示,设NA为阿伏伽德罗常数的值).
pm,则该晶体的密度为 (用含a的代数式表示,设NA为阿伏伽德罗常数的值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验)化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向方向)
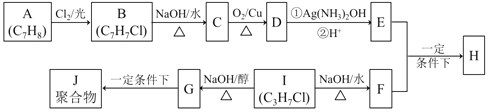
已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称 ,B的结构简式 。
(2)B → C和G → J两步的反应类型 , 。
(3)① E + F → H的化学方程式 。
② I → G 的化学方程式 。
(4)H的同系物K比H相对分子质量小28,K有多种同分异构体。
①K的一种同分异构体能发生银镜反应,也能使FeCl3溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式 。
②若K的同分异构体既属于芳香族化合物,又能和饱和NaHCO3溶液反应放出CO2。则满足该条件的同分异构体共有__________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活息息相关。下列说法不正确的是
A.玻璃、水晶和陶瓷都是传统硅酸盐材料
B.可溶性铝盐和铁盐可用作净水剂
C.SO2和NO都能形成酸雨而破坏环境
D.CO2和CH4都是引起温室效应的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
(1) X、Y、Z的第一电离能从大到小的顺序是___________(用元素符号表示,下同)。
(2)写出W的价电子排布式_____________,W同周期的元素中,与W原子最外层电子数相等的元素还有____________。
(3)根据等电子体原理,可知化合物XZ的结构式是__________, YZ2-的VSEPR模型是___________。
(4) X、Y、Z的.简单氮化物的键角从大到小的顺序是_______(用化学式表示),原因是________________
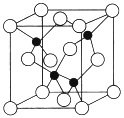
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式___________,该物质硬度大,推测该物质为_________晶体。其中Y元素的杂化方式是______。
(6)U的晶体属立方晶系,其晶胞边长为405pm ,密度是2.70g/cm3,通过计算确定其晶胞的类型_____(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com