
����Ŀ��ij��ȤС���������ͼ��ʾװ�ã����ּг�װ������ȥ������ʵ��̽���� ��ʵ��һ��̽��Ӱ�컯ѧ��Ӧ���ʵ����أ�
Բ����ƿ��װпƬ������ʵ��������пƬ��С��������ͬ������ѹ��Һ©����װϡ���ᣬ������20.0mL����Ϊ��ʱ�յ㣬���Ϊt1��t2 ��
��� | V��H2SO4��/mL | c��H2SO4��/molL��1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 3 | t2 |
����װ�������Եķ����� ��
�Ƚ�ʵ��I�͢���Եó��Ľ����� ��
��ʵ�����̽�����ĵ绯ѧ��ʴ��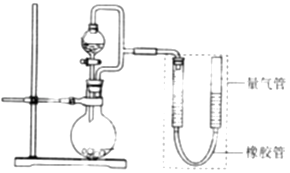
��Բ����ƿ��װ���ۺ�̼�ۻ�����ѹ��Һ©����װϡ���ᣬ��������ϡ������������г��ֵ������ǣ����Һ���Ҳ�Һ����ѡ������������½�������
��Բ����ƿ��װ�����ͬ�������ۺ�̼�ۻ�����ѹ��Һ©����װʳ��ˮ����������ʳ��ˮ����Ԥ���������г��ֵ������ǣ� �� ʵ�ʹ۲쵽�����������Ԥ�Ⲣ��һ�£�װ�����������ã�ԭ���� ��
���𰸡����������Ҳ�ܿڼ�ˮ���������ܳ���Һ��߶Ȳ�ʱֹͣ��ˮ�����ϳ�ʱ���ܱ���Һ��߶Ȳ�䣬��˵��װ�������Ժã�����������һ��ʱ����ѧ��Ӧ�����淴Ӧ��Ũ�ȵ�����������½���������������ʴ������������Ӧ����ʹ�����¶����ߣ�������ѹǿǡ�ò��䣬Һ��û������������������ʴ���������������������С
���������⣺��ʵ��һ����ʵ��װ�÷����ü�������Եķ����Ǵ��������Ҳ�ܿڼ�ˮ���������ܳ���Һ��߶Ȳ�ʱֹͣ��ˮ�����ϳ�ʱ���ܱ���Һ��߶Ȳ�䣬��˵��װ�������Ժã� ���Դ��ǣ����������Ҳ�ܿڼ�ˮ���������ܳ���Һ��߶Ȳ�ʱֹͣ��ˮ�����ϳ�ʱ���ܱ���Һ��߶Ȳ�䣬��˵��װ�������Ժã�
t1��t2 �� ˵��ʵ���Ӧ���ʽϴ���Ũ�Ȳ�ͬ��˵������������һ��ʱ����ѧ��Ӧ�����淴Ӧ��Ũ�ȵ����������
���Դ��ǣ�����������һ��ʱ����ѧ��Ӧ�����淴Ӧ��Ũ�ȵ����������ʵ�������Fe+H2SO4=FeSO4+H2�������������ɣ����ҷ��ȣ���ѹǿ���ӣ������Һ���½����Ҳ�Һ��������
���Դ��ǣ��½��������������������ķ�ӦΪO2+4e��+4OH��=2H2O���ҷ�Ӧ���ȣ�Ԥ���������г��ֵ������ǣ�������ʴ������������Ӧ����ʹ�����¶����ߣ�������ѹǿǡ�ò��䣬Һ��û��������ʵ�ʹ۲쵽�����������Ԥ�Ⲣ��һ�£�װ�����������ã�ԭ���Ƿ���������ʴ���������������������С��
���Դ��ǣ�������ʴ������������Ӧ����ʹ�����¶����ߣ�������ѹǿǡ�ò��䣬Һ��û������������������ʴ���������������������С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ԭ�ӽṹ����ʶ��������ģ�����ԭ�ӽṹģ�������н�ʵ�ʵ���
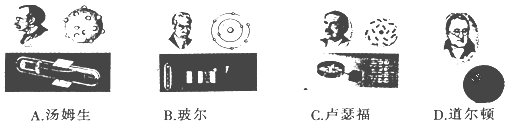
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�PM 2.5��SO2��NOx�ȣ��Լ���������������Ҫ���壮ȡij����������ˮ�����Ƴɴ���Һ�������������ӵĻ�ѧ��ּ���Ũ�����±���
���� | K+ | Na+ | NH4+ | H+ | SO42�� | NO3�� | Cl�� |
Ũ��/molL��1 | 4��10��6 | 6��10��6 | 2��10��5 | a | 2��10��5 | 3��10��5 | 2��10��5 |
��ش��������⣺
��1�����ݱ������ݼ���˴���Һ��c��H+��Ũ��aΪ________mol/L��
��2��NOx������β���е���Ҫ��Ⱦ��֮һ��
����������������ʱ�ĸ��»�����N2��O2��Ӧ����Ӧ�Ļ�ѧ����ʽ��__________��
��NOx���γ����꣬��NO2�γ��������Ҫ��Ӧ��______________��д��ѧ����ʽ����
��3��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
����ȼú�м�����ʯ�ҿ�����������ã�SO2�����պ�ת����һ����Ԫ�ص����̬�Ļ�����û����ﳣ��Ϊ����������ԭ�ϣ����ڶ��������е�������___________��
�����������е�SO2���������ʿ������ռ�����_______������ţ���
a��NaOH b��H2SO4 c��NaHSO3 d. Na2SO3
���Ṥҵ�е�β��SO2����ѭ�����ã�д��SO2ת��ΪSO3��Ӧ�Ļ�ѧ����ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������K2SO4MgSO42CaSO4��ˮ�д�������ƽ�⣺K2SO4MgSO42CaSO4 ��s��2Ca2++2K++Mg2++4SO42�� �� ��ͬ�¶��£�K+�Ľ���Ũ�����ܽ�ʱ��Ĺ�ϵ��ͼ��ʾ��������˵��������ǣ� �� 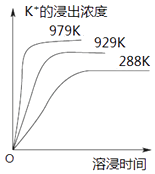
A.��ƽ���Ksp=c2��Ca2+��c2��K+��c��Mg2+��c4��SO42����
B.�����ϵ�м��뱥��K2SO4��Һ���ܽ�ƽ�������ƶ�
C.�����¶ȣ��ܽ���������ƽ��������Ӧ�����ƶ�
D.�����ϵ�м��뱥��NaOH��Һ���ܽ�ƽ�ⲻ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��Si�����ڵڢ�A��Ԫ�أ������й�˵����ȷ����( )
A. C��Si�������õĵ������B. CO2��SiO2�����¶�����̬
C. CH4��SiH4���ǹ��ۻ�����D. H2CO3��H2SiO3���Ƕ�Ԫǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���������з����ⶨijˮ����O2�ĺ�����

��1��ʵ��ԭ��
����ͼ��ʾװ�ã�ʹ�ܽ���ˮ�е�O2�ڼ��������½�Mn2+������MnO(OH)2������I-�����ɵ�MnO(OH)2�ٻ�ԭΪMn2+���ڶ�����Ӧ�����ӷ���ʽΪ___________________��Ȼ����Na2S2O3����Һ�ζ����ɵ�I2��
��֪����2Mn2++O2+4OH-=2 MnO(OH)2 ��I2+2Na2S2O3=2NaI+Na2S4O6��
��S2O32-+2H+=SO2��+S+H2O
��2��ʵ�鲽��
�ٴ�ֹˮ��a ��b����A ����װ���ڹ������N2���˲�����Ŀ����______________��
����ע������ȡijˮ��20.00 mL��A ��ע����ƿ��
���ٷֱ��A ��ע�뺬m mol NaOH��Һ��������MnSO4��Һ��
��������������ر�a��b������ƿ����Һ�����
�ݴ�ֹˮ��a��b���ֱ��A ��ע������NaI��Һ����n mol H2SO4��������Һʹ��Һ�ӽ����ԣ�
���ظ��ܵIJ�����
��ȡ����ƿ�������м���2��3��________________��ָʾ����
����0.005 mol`L-1Na2S2O3�ζ����յ㡣
��3�����ݷ���
�����ڵζ����������ĵ�Na2S2O3����Һ���Ϊ3.60 mL�����ˮ����������O2���ĺ���Ϊ___����λ��mg��L-1����
����δ��Na2S2O3����Һ��ϴ�ζ��ܣ�����ˮ����O2�ĺ�����____________(�ƫ����ƫС�����䡱)��
��ʵ��Ҫ�����������H2SO4ʹ��Һ�ӽ����ԣ���ԭ����__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯����һ����Ҫ���뻹ԭ������(����)
A. KClO3��KCl B. KCl��AgCl
C. H����H2 D. C��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M2O7x����S2-��������Һ�з������·�Ӧ��M2O7x��+3S2-+14H+2M3++3S��+7H2O����M2O7x����M�Ļ��ϼ���( )
A. +2 B. +4 C. +6 D. +3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ʱ����淴ӦaA+bBcC�����ʵĺ���A%��C%���¶ȵı仯������ͼ��ʾ������˵����ȷ���ǣ� �� 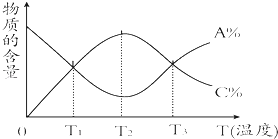
A.�÷�Ӧ��T1��T3�¶�ʱ�ﵽ��ѧƽ��
B.�÷�Ӧ��T2�¶�ʱ�ﵽ��ѧƽ��
C.�÷�Ӧ���淴Ӧ�Ƿ��ȷ�Ӧ
D.�����¶ȣ�ƽ���������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com