
【题目】经一定时间后,可逆反应aA+bBcC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( ) 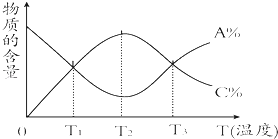
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
【答案】B
【解析】解:T2℃之前A%变小,C%从0渐增大,而T2℃之后A%渐大,C%渐小,说明T2℃之前是反应没有达到平衡状态,而T2℃时恰好平衡,T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应. A、T1温度之后A%继续变小,C%继续增大,T3温度之后A%继续增大,C%继续减小,故T1、T3温度时未达到化学平衡,故A错误;
B、T2℃之前A%变小,C%从0渐增大,而T2℃之后A%渐大,C%渐小,说明T2℃之前是反应没有达到平衡状态,故B正确;
C、T2℃时恰好平衡,T2℃之后A%渐大,C%渐小,说明T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应,故C错误;
D、T2℃时恰好平衡,T2℃之后A%渐大,C%渐小,说明T2℃之后是温度升高使平衡向逆反应移动,故D错误.
故选B.


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究. 【实验一】探究影响化学反应速率的因素.
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2 .
序号 | V(H2SO4)/mL | c(H2SO4)/molL﹣1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 3 | t2 |
检查该装置气密性的方法是 .
比较实验I和Ⅱ可以得出的结论是 .
【实验二】探究铁的电化学腐蚀.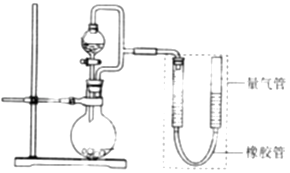
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面右侧液面(选填“上升”、“下降”).
②圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是: . 实际观察到的现象可能与预测并不一致,装置气密性良好,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(H2O2)和水都是极弱的电解质,但H2O2 溶液显弱酸性。把H2O2 看成二元弱酸,则下列化学方程式不正确的是
A. H2O2 在水中电离的离子方程式:H2O2![]() H++HO2-
H++HO2-
B. 少量Na2O2与稀盐酸反应的离子方程式:O22-+2H+==H2O2
C. H2O2 稀溶液与Ba(OH)2稀溶被反应生成正盐的化学方程式:H2O2 +Ba(OH)2=BaO2+2H2O
D. H2O2 稀溶液与Ba(OH)2 稀溶液反应生成酸式盐的化学方程:2H2O2 +Ba(OH)2=Ba(HO2)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 . a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 , 氧化性最弱的简单阳离子是(填离子符号) .
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
①工业制镁时,电解MgCl2而不电解MgO的原因是
②制铝时,电解Al2O3而不电解AlCl3的原因是; ③写出电解Al2O3反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,汽车尾气已成为许多大城市空气的主要污染。汽车尾气中含有CO、NO等多种污染物。
⑴汽车燃料中一般不含氮,尾气中所含的NO产生的化学方程式为__ ___ ____。
⑵ 治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装上一个催化转化装置,使NO和CO反应,生成CO2和 N2。反应的化学方程式为 ___ _______。
⑶ 下列措施中,能减少或控制汽车尾气污染有效且可行的是__ ___
① 制定严格的尾气排放标准,并严格执行。
② 开发清洁能源,如氢能汽车、太阳能汽车等。
③ 市民出行带防毒面具。
④ 市民大量移居城市郊区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下图所示。
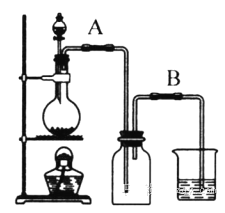
(1) 实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置后,用弹簧夹夹住_____(填“A”或“B”)处橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中_____时,表明该装置不漏气。
(2) 研究性学生小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是_______(填序号)。
A. 氢氧化钠溶液
B. 碳酸钠溶液
C.浓硫酸
(3)写出浓盐酸与二氧化锰加热反应制取氯气的化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是离子反应又是氧化还原反应的是( )
A. 铁片放入CuSO4溶液中 B. 盐酸和氧化镁
C. BaCl2溶液中滴入稀硫酸 D. 氢气还原氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现。下列有关说法中,正确的是 ( )
A.H2与H3中存在氢键B.O2与O4互为同位素
C.C60分子中有范德华力D.N5+中含有34个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( ) ![]()
A.原子半径:rW>rZ>rY>rX
B.Y的氧化物是酸性氧化物,不与任何酸反应
C.最简单气态氢化物的热稳定性:H2W>ZH4
D.X元素的非金属性比Y元素的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com