
【题目】目前,汽车尾气已成为许多大城市空气的主要污染。汽车尾气中含有CO、NO等多种污染物。
⑴汽车燃料中一般不含氮,尾气中所含的NO产生的化学方程式为__ ___ ____。
⑵ 治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装上一个催化转化装置,使NO和CO反应,生成CO2和 N2。反应的化学方程式为 ___ _______。
⑶ 下列措施中,能减少或控制汽车尾气污染有效且可行的是__ ___
① 制定严格的尾气排放标准,并严格执行。
② 开发清洁能源,如氢能汽车、太阳能汽车等。
③ 市民出行带防毒面具。
④ 市民大量移居城市郊区。
【答案】⑴N2 + O2 ![]() 2NO;
2NO;
⑵ 2NO + 2CO![]() N2 + 2CO2;⑶ ①②。
N2 + 2CO2;⑶ ①②。
【解析】(1)汽车燃料中一般不含氮元素,尾气中所含的NO是在高温下空气中的N2和O2反应生成的,化学方程式为N2+O2![]() 2NO 。
2NO 。
(2)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2。反应的化学方程式是2NO+2CO=N2+2CO2。
(3)①制定严格的汽车尾气排放标准,并严格执行,能减少或控制汽车尾气污染,可行;②开发清洗能源汽车,如氢能汽车、太阳能汽车等,能减少或控制汽车尾气污染,可行;③市民出行戴防护面具,不能减少或控制汽车尾气污染,不可行;④市民大量移居城市郊区,不能减少或控制汽车尾气污染,不可行。所以,能减少或控制汽车尾气污染有效且可行的是①②。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】C和Si都属于第ⅣA族元素,下列有关说法正确的是( )
A. C和Si都是良好的导电材料B. CO2和SiO2常温下都呈气态
C. CH4和SiH4都是共价化合物D. H2CO3和H2SiO3都是二元强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某一元氯代环烷烃A分子式为C6H11Cl,可以发生如图所示的转化: 
结构分析表明A分子中只含有一个甲基,A的核磁共振氢谱有五个峰,峰面积之比为1:1:2:3:4.A转化为B时生成的有机物只可能有一种.请回答下列问题:
(1)写出反应类型:C→E , E→G .
(2)写出结构简式:F , E .
(3)写出反应方程式:A→B , C→D .
(4)分子式和E相同,主链含有5个碳原子的二元羧酸的同分异构体有种(不考虑立体异构).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向盛有2mL0.1mo/LAgNO3溶液的试管中滴加一定量0.1mo/LNaCl溶液,再向其中滴加一定量0.1mol/LKI溶液 | 证明相同温度下的溶度积常数Ksp(AgCl)>Ksp(AgI) |
B | 取两支试管,分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一支试管中加入0.1mol/LH2C2O4液2mL,向另一支试管中加入0.1mol/L H2C2O4液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越大 |
C | 向盛有1mL浓硫酸的试管中加入5mL0.01mol/LK2Cr2O7溶液 | 证明增大生成物的浓度,使平衡Cr2O72-(橙色)+H2O |
D | 向混有BaCO3沉淀的NaOH溶液中满入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中的NaOH含量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经一定时间后,可逆反应aA+bBcC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( ) 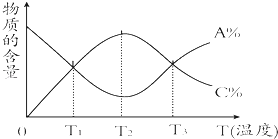
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种原子序数依次增大的短周期元素.A与其余五种元素既不同周期,也不同主族;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,其中B的单质为空气中的主要成分之一.
(1)A、B形成的化合物液态时可发生微弱电离,电离产生的阴离子的电子式为 .
(2)某含F的盐矿石的组成可以看作其氧化物中有 ![]() 的F被E替换,再由D平衡其电荷形成的.该矿石的化学式为 . (用氧化物形式表示)
的F被E替换,再由D平衡其电荷形成的.该矿石的化学式为 . (用氧化物形式表示)
(3)工业中制备单质E的阳极电极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+的浓度与Cl﹣的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
A.适量的HCl
B.适量的NaCl
C.适量的氨水
D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1mol氢气中的化学键需要436.4kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,形成水分子中的1molH﹣O键能够释放462.8kJ能量,则下列热化学方程式中正确的是( )
A.2H2(g)+O2(g)═2H2O(g)△H=﹣480.4kJ/mol
B.H2(g)+ ![]() O2(g)═H2O(l)△H=﹣240.2kJ/mol
O2(g)═H2O(l)△H=﹣240.2kJ/mol
C.2H2(g)+O2(g)═2H2O(g)△H=+480.4kJ/mol
D.H2(g)+ ![]() O2(g)═H2O(l)△H=﹣480.4kJ/mol
O2(g)═H2O(l)△H=﹣480.4kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com