
| A. | 酒精和碘 | B. | 硝基苯和水 | C. | 乙醇和水 | D. | 溴和溴苯 |
科目:高中化学 来源: 题型:选择题
| A. | H2SO4和H2SO3 | B. | (HO)2RO2和(HO)2RO3 | C. | HNO3和HNO2 | D. | HClO4和H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中处于第三周期ⅦA族 | B. | 在周期表中处于第二周期ⅤA族 | ||
| C. | 氢化物稳定性比PH3弱 | D. | 常见化合价只有-3、+2、+3、+5价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 可能有乙烷 | D. | 一定有丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素位于周期表的第二周期0族 | |
| B. | 该元素最高价氧化物对应水化物为强碱 | |
| C. | 该元素第一电离能为本周期最小 | |
| D. | 该元素电负性为短周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:14C | |
| B. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | Cl-离子的结构示意图 | |
| D. | 氯化钠的电子式: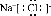 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中大量存在硅单质 | |
| B. | 石英、水晶、硅石的主要成分都是SiO2 | |
| C. | 自然界中SiO2都存在于石英矿中 | |
| D. | SiO2为集成电路和光电池的材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com