
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类: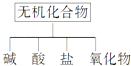
(1)如图所示的物质分类方法名称是 .
(2)以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在表②③⑥的后面.
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl | ③ | ⑤Na2CO3 | ⑦CO2 |
(3)写出⑦转化为⑤的离子方程式: .
(4)实验室制备⑦常用和反应(写物质的化学式),检验该气体的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各式中,属于正确的电离方程式的是( )
A.HCO3﹣+H2OH2CO3+OH﹣
B.HCO3﹣+OH﹣=H2O+CO32﹣
C.NH3+H+=NH4+
D.NH3H2ONH4++OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下.NH4Cl溶液加水稀释, ![]() 增大
增大
B.0.1mol/LNa2CO3溶液加热后,溶液的pH减小
C.室温下稀释O.lmol/LCH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为_____________。

(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。T______100 ℃(填“大于”或“小于”),判断理由是____________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2 . 
(1)A分子的质谱图如图所示,从图中可知其相对分子质量是 , 则A的分子式是;
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是 .
(3)A分子的核磁共振氢谱有4个吸收峰,峰面积之比是1:1:1:3,则A的结构简式是;
(4)写出两分子A生成六元环酯的化学方程式:;
(5)请写出官能团与A相同的同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的装置,判断下列说法正确的是( ) 
A.该装置中a极为负极
B.当装置中某一块铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为4.48 L
C.该装置中b极的电极反应式是:H2﹣2e﹣=2H+
D.一段时间后,左边装置中溶液pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com