
分析 (1)按照甲同学的观点,HCO3-电离生成H+和CO32-,CO32-与Cu2+反应生成CuCO3沉淀,H+与HCO3-反应生成CO2和H2O;
(2)乙同学认为有Cu(OH)2生成的理论依据NaHCO3溶液加入到CuSO4溶液中铜离子交换碳酸氢根离子水解生成的氢氧根离子生成氢氧化铜沉淀,促进水解反应进行;
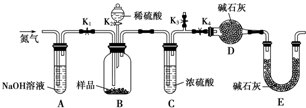
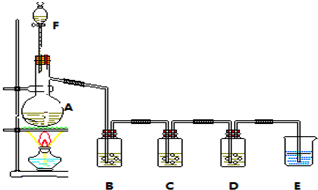
(3)①将沉淀从溶液中分离并净化,应进行过滤、洗涤和干燥等操作;
②为准确测定生成CO2的质量,应防止空气中CO2和水蒸气进入装置;
③为减小实验误差,应先通入过量经NaOH处理的空气,排除装置内的二氧化碳气体,一段时间之后,再进行实验,最后还要通入过量经NaOH处理的空气,使生成的二氧化碳全部被吸收;在分液漏斗上部和集气瓶之间连接橡胶管是为了保持两个装置中气压相等,使硫酸顺利滴下,对准确测定水和二氧化碳的质量没有影响;
④装置D的质量增加了ng,应为CO2的质量,则n(CuCO3)=$\frac{ng}{44g/mol}$,以此计算沉淀中CuCO3的质量分数;
(4)除题中实验方案外,还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量等方法来测定沉淀中CuCO3的质量分数.
解答 解:(1)按照甲同学的观点,HCO3-电离生成H+和CO32-,CO32-与Cu2+反应生成CuCO3沉淀,H+与HCO3-反应生成CO2和H2O,
反应的方程式为:Cu2++2HCO3-=CuCO3↓+CO2↑+H2O,
故答案为:Cu2++2HCO3-=CuCO3↓+CO2↑+H2O;
(2)乙同学认为有Cu(OH)2生成的理论依据是:HCO3-+H2O?H2CO3+OH-、Cu2++2OH-=Cu(OH)2↓;
故答案为:HCO3-+H2O?H2CO3+OH-、Cu2++2OH-=Cu(OH)2↓;
(3)①将沉淀从溶液中分离并净化,应进行过滤、洗涤和干燥等操作,
故答案为:过滤;干燥;
②为准确测定生成CO2的质量,应防止空气中CO2和水蒸气进入装置,
故答案为:防止空气中CO2和水蒸气进入装置D;
③为减小实验误差,应先通入过量经NaOH处理的空气,排除装置内的二氧化碳气体,即打开K1、K3,关闭K2、K4,通入过量空气,一段时间之后,再关闭K1、K3,打开K2、K4,充分反应,最后还要通入过量经NaOH处理的空气,使生成的二氧化碳全部被吸收,即打开K1、K4,关闭K2、K3,通入过量空气,如若未进行步骤b,将使测量结果偏低;在分液漏斗上部和集气瓶之间连接橡胶管是为了保持气压相等,使分液漏斗中硫酸顺利流下,该装置中不需要此操作,且与准确测定水和二氧化碳的质量没有关系,
故答案为:cab; b;否;
④装置D的质量增加了ng,应为CO2的质量,则n(CuCO3)=$\frac{ng}{44g/mol}$=$\frac{n}{44}$mol,
则沉淀中CuCO3的质量分$\frac{31n}{11m}$×100%;
(4)除题中实验方案外,还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量等方法来测定沉淀中CuCO3的质量分数,
故答案为:样品质量和样品充分灼烧后的质量.
点评 本题考查学生对实验原理与装置的理解评价、对实验操作的理解、物质含量的测定、化学计算等知识,题目难度中等,是对所学知识的综合运用,需要学生具备扎实的基础知识与分析问题、解决问题能力.


科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知反应:2NO2(红棕色) 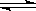 N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
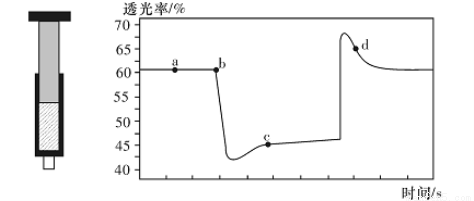
A.b点的操作是拉伸注射器
B.d点:v(正)>v(逆)
C.c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc
D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
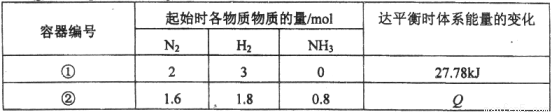
同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3 H2(g)
H2(g) 2NH3(g) △H= -92.6 kJ / mol。测得数据如下表:
2NH3(g) △H= -92.6 kJ / mol。测得数据如下表:
下列叙述不正确的是
A.容器②中反应开始时v(正)> v(逆)
B.容器①、②中反应达平衡时压强相等
C.容器②中反应达平衡时,吸收的热量Q为9.26 kJ
D.若条件为“绝热恒容”,容器①中反应达平衡时n (NH3)< 0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、溴苯、四氯化碳 | B. | 苯、乙醇、四氯化碳 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4O | B. | C2H6O | C. | C3H4O2 | D. | C3H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水存放在带橡胶塞的棕色广口瓶中 | |
| B. | 少量钠保存在煤油中 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 碳酸钠固体保存在广口瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com