
【题目】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=_____,通过实验/span>_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是______________________________;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为____________。
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式_________________________。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
【答案】 浓度 1 293K BC 其他条件相同时,增大反应物浓度,反应速率增大 8.3×10-4mol/(L·s) 2MnO42-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 作催化剂 Mn2+
【解析】(1)实验A、B中KMnO4溶液的浓度相等,可探究出在相同温度下,H2C2O4溶液浓度的改变对反应速率的影响,其中V1=2mL+4mL-2mL-3mL=1mL,T1=293K;B和C实验中,V2=3mL时,两实验反应物的浓度均相同,可探究不同温度对化学反应速率的影响;
(2)因A中H2C2O4溶液浓度浓度比B中大,若t1<8,则由实验A、B可以得出的结论是其他条件相同时,增大反应物浓度,反应速率增大;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为![]() =8.3×10-4mol/(L·s);
=8.3×10-4mol/(L·s);
(3)反应中有无色无味气体CO2产生且锰被还原为Mn2+,则发生反应的离子方程式为2MnO42-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(4)KMnO4与H2C2O4反应后的溶液中出现了Mn2+,Mn2+可能是此反应的催化剂,促进了反应速率加快。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列叙述错误的是( )
A. 硅胶、铁粉均可作为食品包装中的抗氧化剂
B. 福尔马林能防腐,但不能用于食品保鲜
C. 可溶性的铝盐和铁盐可用作净水剂
D. 人工合成的硅橡胶是既耐高温又耐低温的橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
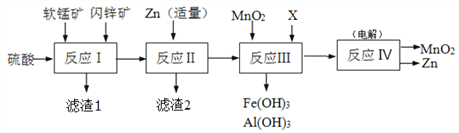
已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行的反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H 。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见右图中曲线①②③),测得CO2的平衡转化率与温度关系如下图所示,
C2H5OH(g)+3H2O(g) △H 。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见右图中曲线①②③),测得CO2的平衡转化率与温度关系如下图所示,

下列有关说法正确的是
A.该反应:△H >0
B.氢碳比:①<②<③
C.其它条件不变的情况下,缩小容器的体积可提高CO2的转化率
D.若起始CO2浓度为2mol·L-1、H2为4mol·L-1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)能源危机是当前全球问题,开源节流是应对能源危机的重要举措。下列做法有助于能源“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如下图所示。

①在通常状况下,金刚石和石墨中_______更稳定,石墨的燃烧热为__________。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为_______。
(3)由石墨转变成金刚石的反应的ΔS=+1.6J·mol-1·K-1,则为了保持此反应自发进行,温度应______(填“低于”或“高于”)______K。
(4)已知熔融碳酸盐燃料电池的工作原理如下图所示:

①放电过程中K+和Na+向电极_______(填“A”或“B”)移动。
②该电池的负极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量转换的说法正确的是( )
A. 煤燃烧是化学能全部转化为热能的过程
B. 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C. 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
①化学性质相似的有机物是同系物 ②分子组成相差一个或几个CH2的有机物是同系物 ③若烃中碳、氢元素的质量分数相同,它们必是同系物 ④具有同一通式的物质属于同系物
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能使溴水和酸性KMnO4溶液褪色,又能发生银镜反应的是( )
A. CH3—CH=CH2 B. CH2=CH—CH2OH
C. CH3CH2CH2OH D. CH2=CH—CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一实例能证明微量元素是生命活动必需的 ( )
A. Mg是叶绿素的组成成分 B. 油菜缺少B时只开花不结果
C. 哺乳动物体内Ca盐含量太低,会抽搐 D. 缺少P会影响ATP的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com