
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( ) 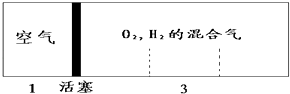
A.2:7
B.4:5
C.5:4
D.7:6
【答案】B
【解析】解:反应前左右压强都相等,气体的物质的量之比等于体积之比,设空气的物质的量为1mol,则氢气、氧气的混合气体为3mol;反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,①若剩余的气体为H2 , 参加反应气体共2mol,由2H2+O2 ![]() 2H2O可知,混合气体中O2的物质的量为:2mol×
2H2O可知,混合气体中O2的物质的量为:2mol× ![]() =
= ![]() mol,则氢气的物质的量为:3mol﹣
mol,则氢气的物质的量为:3mol﹣ ![]() mol=
mol= ![]() mol,相同条件下体积之比等于物质的量之比,所以原混合气体中H2、O2的体积比为
mol,相同条件下体积之比等于物质的量之比,所以原混合气体中H2、O2的体积比为 ![]() mol:
mol: ![]() mol=7:2;②若剩余的气体为O2 , 参加反应气体共2mol,由2H2+O2
mol=7:2;②若剩余的气体为O2 , 参加反应气体共2mol,由2H2+O2 ![]() 2H2O可知,混合气体中H2的物质的量为:2mol×
2H2O可知,混合气体中H2的物质的量为:2mol× ![]() =
= ![]() mol,则氧气的物质的量为:3mol﹣
mol,则氧气的物质的量为:3mol﹣ ![]() mol=
mol= ![]() mol,相同条件下体积之比等于物质的量之比,所以原混合气体中H2、O2的体积比为
mol,相同条件下体积之比等于物质的量之比,所以原混合气体中H2、O2的体积比为 ![]() mol:
mol: ![]() mol=4:5,故选B. 反应前左右压强都相等,气体的物质的量之比等于体积之比,设空气的物质的量为1mol,则氢气、氧气的混合气体为3mol;反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,剩余的气体可能为氢气,也可能为氧气,据此进行讨论计算.
mol=4:5,故选B. 反应前左右压强都相等,气体的物质的量之比等于体积之比,设空气的物质的量为1mol,则氢气、氧气的混合气体为3mol;反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,剩余的气体可能为氢气,也可能为氧气,据此进行讨论计算.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质反应时,反应条件或反应物用量的改变,对生成物没有影响的是
A. Cl2和H2 B. Na和O2 C. Ca(OH)2和CO2 D. C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g)cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( ) 
A.达平衡后,若升温,平衡左移
B.达平衡后,加入催化剂则C%增大
C.化学方程式中a+b>c+d
D.达平衡后,减少A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学胃部不适,医生诊断后让其服用胃舒平【主要成分为Al(OH)3】.试分析下列饮食中,该同学在服药期间不宜食用的是( )
A.松花蛋
B.纯净水
C.可乐
D.馒头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下,铜片和稀硫酸在任何条件下都不反应
B.碘化钾与浓硫酸反应可制备碘化氢
C.过氧化氢常温下不会分解,水溶液没有酸性
D.铝箔在氯气中燃烧可制备无水三氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ?mol﹣1
B.C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H=+2b kJ?mol﹣1
O2(g)═2CO2(g)+H2O(l)△H=+2b kJ?mol﹣1
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ?mol﹣1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸在化学工业中有着极其广泛的应用.
(1)将1.25mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是 .
(2)向稀硝酸中加入18.4mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8g/cm3)以下时,则失去吸水能力.50mL 18.4mol/L的浓硫酸作为吸水剂时,最多可吸水g.
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸).若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比 ![]() = .
= .
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O.现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收.已知反应后溶液含有0.35molNaNO2 . 若将尾气NO和NO2的平均组成用NOx表示,则x= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com